吸引艾伯维下注,天境生物的CD47到底是什么?
两起高值交易
一夜之间,创新肿瘤免疫疗法再次抢占头条,不过这次不再是PD-(L)1,而是CD47。
9月4日,天境生物(IMAB. NASDQ)和艾伯维(AbbVie)共同宣布就天境生物自主研发的创新CD47单抗lemzoprlimab(TJC4)的开发和商业化建立广泛的全球战略合作关系,天境生物将获得总额19.4亿美元的分期里程碑付款,以及未来全球销售额中两位数比例的分级特许权使用费。这一合作,成为中国创新药行业又一里程碑式的事件。
半年前,吉利德(Gilead)宣布以总值49亿美元收购了专注研发CD47通路抑制剂的生物技术公司Forty Seven(数字47的英文为forty-seven)。这是吉利德继2017年以12亿美元收购CAR-T疗法研发企业Kite Pharma后的又一次较大规模收购。
以上两起高值收购均具有较强的针对性,是艾伯维和吉利德分别从自体免疫和病毒感染向肿瘤治疗领域切换的重要举措,向全球市场透露了重要信号:靶向CD47通路的肿瘤免疫疗法极具潜力。
CD47通路的机制
1957年,Burnet和Thomas提出“免疫监视”假说,认为免疫系统可以监测和消除“外来”实体,以维持稳态环境,包括表达各种肿瘤特异性和非肿瘤特异性抗原的恶性细胞。肿瘤免疫监视是限制肿瘤生长的重要过程,巨噬细胞(macrophages)在识别和清除体内肿瘤细胞中发挥了重要作用。T淋巴细胞和NK细胞是免疫系统的其他重要效应细胞,在抗肿瘤免疫中也发挥着重要作用。在肿瘤浸润的免疫细胞中,巨噬细胞和T淋巴细胞是占比最高的两群细胞。
肿瘤细胞对免疫识别和清除的逃避行为依赖于多个过程,包括诱导免疫抑制肿瘤微环境和降低肿瘤细胞的免疫原性。肿瘤细胞免疫逃逸的一个关键机制是免疫抑制信号分子CD47的过表达。CD47是一种存在于多种不同细胞类型表面的糖基化的跨膜蛋白,结构包括氨基末端的胞外可变区、高疏水性跨膜段形成的跨膜区,以及在细胞质中的亲水羧基末端。CD47的配体包括SIRPα、TSP-1(血小板反应蛋白-1)及整合素αvβ3和α2β1。SIPRα在髓系细胞膜上高表达,如巨噬细胞、粒细胞、单核细胞和髓系树突状细胞,其胞外区域包含可与CD47结合的V形氨基末端。
图表1. CD47和SIRPα的结构和相互作用示意
ITIM(基于酪氨酸的免疫受体抑制基序)、SHP-1/2(蛋白质酪氨酸磷酸酶底物-1/2)
来源:Front. Immunol.、中康产业资本研究中心
靶向CD47-SIRPα通路的抗肿瘤疗法
大量研究表明,CD47在不同类型的肿瘤中过表达,包括急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)、慢性髓系白血病(CML)、非霍奇金淋巴瘤(NHL)、骨髓瘤、平滑肌肉瘤、骨肉瘤、乳腺癌、头颈部鳞状细胞癌(HNSCC)、膀胱癌、肺癌和肝细胞癌(HCC)。多种肿瘤细胞表面过表达CD47可以帮助逃脱免疫细胞的监控和清除,而且表达水平与疾病进展正相关。CD47在肿瘤中的广泛表达使针对CD47通路的药物在理论上可以与PD-(L)1药物一样用于多种肿瘤的治疗。
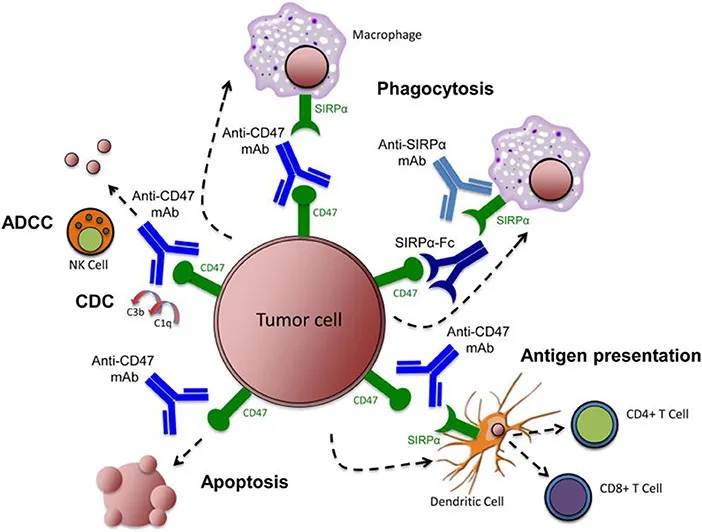
(1)抗CD47抗体、抗SIRPα抗体或重组SIRPα蛋白抑制CD47-SIRPα的相互作用,会导致巨噬细胞吞噬肿瘤细胞。
(2)抗CD47抗体使树突状细胞吞噬肿瘤细胞,随后抗原呈递到CD4+和CD8+ T细胞,从而刺激抗肿瘤适应性免疫应答。
(3)抗CD47抗体通过NK细胞(自然杀伤细胞)介导的ADCC(抗体依赖性细胞毒性)和CDC(补体依赖性细胞毒性)来消除肿瘤细胞。
图表2. 靶向CD47-SIRPα通路消除肿瘤细胞的多种机制
天境生物的CD47单抗TJC4
图表3. TJC4的抗原结合表位及与红细胞(RBC)的微弱作用
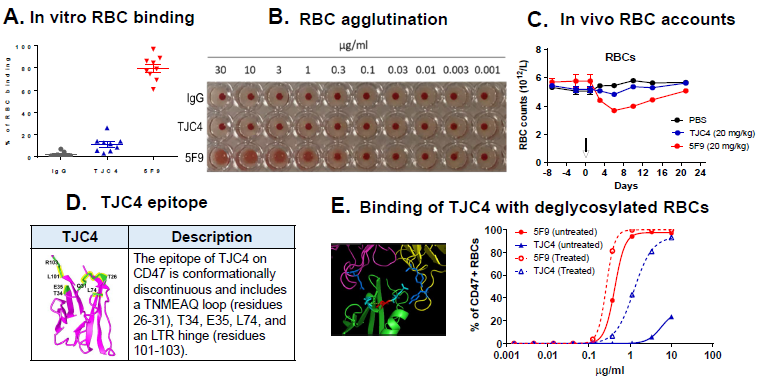
(A)与Forty Seven公司的CD47单抗5F9相比与人红细胞结合更弱。(B) TJC4不会引起凝血。(C)20mg/kg剂量单次注射,TJC4对食蟹猴红细胞计数的影响更小。(D)晶体结构分析TJC4的抗原结合表位。(E)红细胞去糖基化会增加与TJC4的结合。
来源:2019ASH、中康产业资本研究中心
TJC4的特性是通过额外的红细胞反筛选来实现的,筛选到与CD47高亲和力结合但与红细胞不结合或最低限度结合的罕见抗体克隆。该特性在一系列体外和体内实验中得到充分验证。在食蟹猴毒理实验中,TJC4在重复给药高达100mg/kg 的高剂量下,都展现了良好的耐受性,说明治疗窗较宽。这一安全性优势使TJC4在全球同类药物中脱颖而出,有潜力成为同类最佳(best-in-class)疗法。
2019年1月,TJC4获得美国FDA临床试验许可。2019年6月,TJC4在美国完成I期临床研究(NCT03934814)首例患者给药。此项开放标签、多中心、多剂量,临床1期研究旨在评估TJC4单药及与其他抗肿瘤药物联合用药在难治/复发性晚期实体瘤和淋巴瘤患者(n=88)中的安全性、耐受性、药代动力学(PK)、药效学(PD)和初步疗效。该研究分两部分执行,部分1包括单剂量递增(1A)、联合帕博利珠单抗(PD-1单抗)剂量递增(1B)、联合利妥昔单抗(CD20单抗)剂量递增(1C),部分2包括一项剂量扩展研究。2019年9月,天境生物与默沙东(MSD)建立临床合作伙伴关系,就TJC4与默沙东的PD-1单抗Keytruda的联合治疗开展临床研究,评估联合用药在多种类型的肿瘤患者中的临床效果,即上述研究的1B部分。
2019年7月,TJC4的临床试验申请(CXSL1900039)被中国国家药监局批准,临床试验将针对晚期恶性肿瘤的患者。2020年4月,TJC4在中国大陆的临床1/2a期研究成功完成首位患者给药。此项研究为多中心、开放标签的单臂临床试验(NCT04202003),旨在评价TJC4单药治疗复发/难治性急性髓系白血病(AML)和骨髓增生异常综合征(MDS)患者的安全性、耐受性、PK、PD和初步疗效。
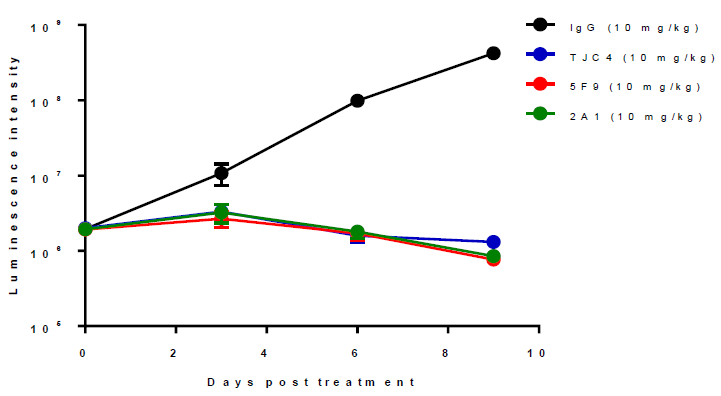
2020年9月,在与艾伯维签订战略合作协议时,天境生物透露的TJC4的美国I期临床研究初步结果显示其在安全性方面的差异化优势以及更优异的药代动力学性质。TJC4单药注射给药从1mg/kg至30mg/kg剂量范围显示出良好的耐受性,且在可评估患者中未观察到剂量限制性毒性(DLT)或严重的血液不良事件。具体的实验结果将于2020年下半年在相关国际学术会议上公布。虽然临床试验结果尚未公布,但在NSG小鼠Raji淋巴瘤细胞移植模型中的试验显示TJC4与Forty Seven公司的5F9、鼠源抗CD47单抗2A1在10mg/kg剂量下具有基本一致的抗肿瘤活性。(图表4)
来源:公司报告、中康产业资本研究中心
Forty Seven的magrolimab
图表5. Forty Seven公司的CD47单抗magrolimab的联合疗法研发进展

2019年12月,Forty Seven在ASH年会上公布magrolimab的最新临床进展,对于高危骨髓增生异常综合征(MDS)患者,总响应率(ORR)为92%,完全缓解率(CR)为50%;对于不适合化疗、未经治疗的急性髓系白血病(AML)患者,总响应率为64%,完全缓解率为41%。
结 语
在解决血液不良反应后,针对CD47-SIRPα通路的创新疗法有望成为继PD-(L)1之后,肿瘤免疫领域又一片丰饶的新大陆。2019年全球PD-(L)1药物市场中,仅默沙东(MSD)、百时美施贵宝(BMS)、罗氏(Roche)、阿斯利康(AstraZeneca)上市的4个PD-(L)1单抗的累计销售额就达到了224.32亿美元。这意味着,CD47药物凭借与PD-1药物相似的广谱抗肿瘤疗效,其潜在市场和可能也将达到200亿的规模。