近日(9月10日),继再鼎医药的CD20xCD3双特异性抗体REGN1979获批临床后,紧接着罗氏的RO7082859的也获批临床,适应症为弥漫性大B细胞淋巴瘤。

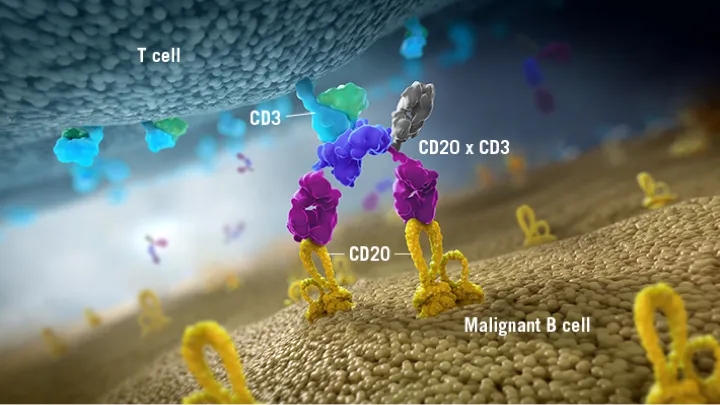
Glofitamab为2:1型CD20/CD3双抗,具有两个与CD20结合的“ Fab”区域和一个与CD3结合的“ Fab”区域,目前Glofitamab已经进入临床III期。这种2:1型的结构设计使其与B细胞表面CD20的结合性更高,诱导快速T细胞活化、细胞因子释放以及导致靶细胞裂解。
此前,在今年的EHA年会上,该公司报告了glofitamab在复发或难治性非霍奇金淋巴瘤(R/R NHL)中的最新临床数据--I期剂量递增研究的积极结果,在中位接受了三线治疗后的患者中,glofitamab显示了在NHL中显示了强大的临床疗效,包括更持久的缓解和可控的安全性。
结果显示:在≥0.6mgglofitamab剂量组中,侵袭性NHL患者的CR为30.9%,总体缓解率(ORR)为45.5%;惰性NHL患者的CR为52.2%,ORR为65.2%。在≥10mg组中,侵袭性NHL患者的CR率为34.1%,ORR为49.4%;惰性NHL患者的CR率为50.0%,ORR为66.7%。对于CR患者,中位随访10.2个月,72.7%侵袭性NHL患者,81.8%的惰性NHL患者仍维持CR。
目前,罗氏正在推进一系列glofitamab临床开发项目,将其作为单一疗法以及其他药物联合,用于治疗CD20阳性的B细胞非霍奇金淋巴瘤,包括弥漫性大B细胞淋巴瘤-DLBCL和滤泡性淋巴瘤--FL及其他血液癌症。
其中,联合用药包括在NHL和其他血液肿瘤中评估glofitamab与ADC药物Polivy、Tecentriq、rituximab和CD20单抗-obinutuzumab的联合用药的研究。
2020年6月9日,信达生物与罗氏达成20亿美元合作,以开发通用CAR-T疗法和TCB双抗,其中glofitamab亦包含在内。
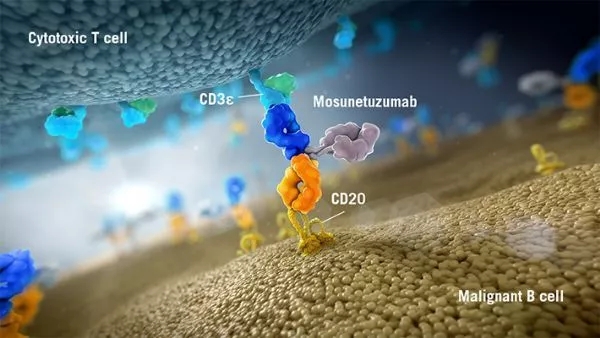
除glofitamab外,罗氏的另一款1:1的CD20/CD3双抗Mosunetuzumab,Mosunetuzumab有两个Fab段,其中一个Fab靶向CD20,另一个靶向CD3。此前在ASH上公布的临床数据显示,Mosunetuzumab在惰性NHL患者中的ORR达到62.7%,43.3%的CR,在侵袭性NHL中的ORR和CR分别为37.1%和19.4%。此前(7月14日),罗氏mosunetuzumab也已获得FDA突破性疗法认定(BTD)。
在去年的ASH年会上,CD20/CD3双抗一站成名,对CAR-T疗法已构成一定威胁,现下,CD20/CD3双抗已是国内外制药巨头们在血液肿瘤中布局双抗的一大重点方向。