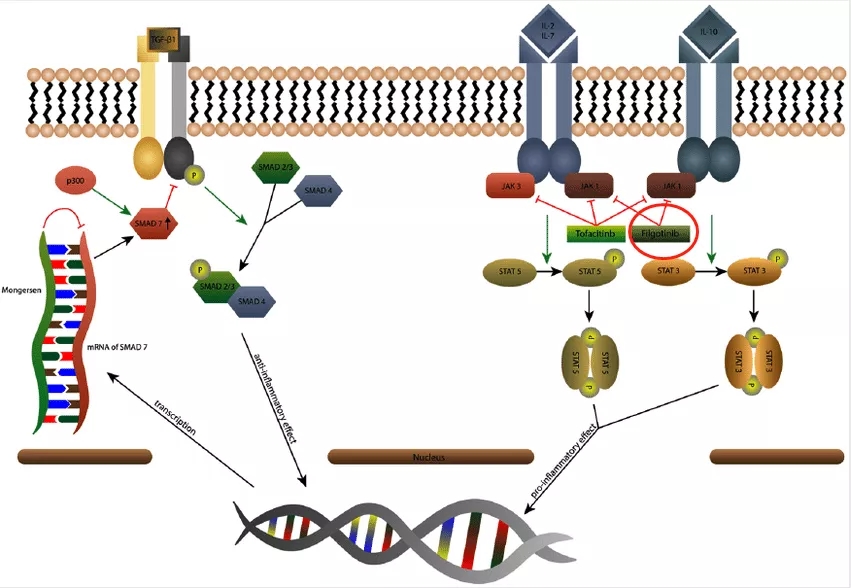
不受影响,吉利德被FDA拒批的JAK1口服抑制剂在欧洲上市
不过filgotinib在美的上市路途遭遇重挫,上个月,filgotinib的上市申请出人意料的遭到FDA拒绝,在完全回复函(CRL)中,FDA表示了对200mg剂量filgotinib的整体收益风险状况的担忧,目前FDA表示需要通过对来自于MANTA和MANTA-RAy临床研究的数据以完成上市审评,此次在欧洲的顺利获批说明FDA的拒批对其在欧洲上市没有造成什么影响。
艾伯维于2012年就与Galapagos签署了一项高达13.5亿美元的协议,共同开发Filgotinib,但之后艾伯维在2015年9月宣布终止合作并将Filgotinib相关权益退还给Galapagos公司。
而就在艾伯维退出仅3个月后(2015年12月底),吉利德以7.25亿美元的首付款+13.5亿美元的里程碑金额与Galapagos达成了一项全球合作协议,以共同开发和商业化filgotinib。2019年7月,吉利德又再次加深了与Galapagos的合作,签订了一项10年期全球研发合作协议。通过该协议,吉利德将获得Galapagos一系列在研产品的相关权益,包括6种处于临时试验阶段的分子、20多个处于临床前阶段的项目和一个经过验证的药物研发平台,交易价值达51亿美元。
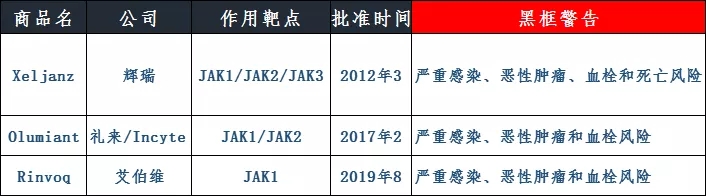
安全性问题一直是JAK抑制剂研发的最突出挑战,已经获批上市的产品多款JAK抑制剂都曾面临着不同程度的安全性问题,FDA批准的3款用于治疗类风湿性关节炎的JAK抑制剂在说明书中都附有黑框警告。
作为RA领域首个JAK抑制剂,Xeljanz及其缓释剂型Xeljanz XR在去年2月收到了FDA “较高剂量的Xeljanz存在肺部血栓和死亡风险” 的药物安全红色警告。同年7月,FDA进一步收紧了对Xeljanz的限制,不仅为其添加了一项黑框警告,还严格限制了10mg Xeljanz的处方。曾被EMA拒绝上市,直到2017年辉瑞提供了补充数据才得以在欧盟上市。
除了JAK抑制剂外,目前IL-6抑制剂在开发类风湿关节炎适应症开发上同样面临安全性挑战,此前,FDA拒绝了强生旗下Sirukumab的新药申请,随后Sirukumab被强生永久性搁置。
作为JAK抑制剂类药物首要适应症的风湿性关节炎市场潜力巨大,但竞争也相对激烈,不少药企已经着手在其他不同适应症中展开了差异性探索,如特应性皮炎,已成为JAK抑制剂类药物抢占市场的又一适应症,去年底,辉瑞宣布其开发的新一代JAK抑制剂abrocitinib在中重度AD关键Ⅲ期临床试验达到了所有的主要终点。