Science:癌症免疫疗法的“七大关键因素”
免疫疗法对临床癌症治疗的影响正在迅速攀升。然而,不同的免疫疗法解决的是癌症-免疫系统交互作用中的不同问题。那么,对每个病人而言,究竟哪种疗法最有效呢?5月6日,在线发表于Science上的题为“The cancer immunogram”的文章中,作者们提出了个体中癌症与免疫系统不同互相作用的框架。他们的目标是聚焦生物标志物研究,帮助指导治疗选择。
癌症免疫交互作用的结果依赖于大量的参数,如T细胞抑制机制等;这些参数的“值”在不同的患者之间差异很大。基于癌症-免疫交互作用的多因子特性,生物标志物检测的联合使用成为一种必然的需要。
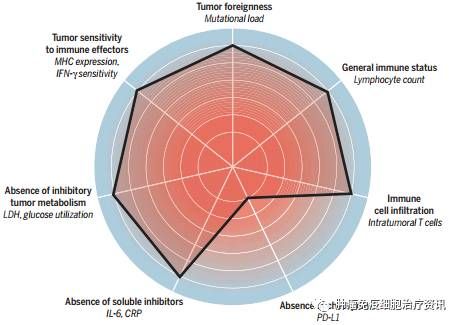
The cancer immunogram(图片来源:Science)
这篇文章中提出的Cancer Immunogram假定了T细胞活性是人类肿瘤中的最终效应机制。这绝不意味着肿瘤相关巨噬细胞的抑制、微生物组的调节等没有价值。作者们假设癌症免疫疗法的疗效最终与增强的T细胞活性相关。未来的研究将验证这一假设是否正确。
同时作者们也承认,他们对癌症-免疫交互作用的理解依然是不完整的。未来,新的生物标志物可能会添加进来,而一些已有的标志物可能被移除。在这个最初的框架中共包含了以下七个参数:
1)Tumor foreignness
T细胞与抗原“相遇”的结果受T细胞检查点的调节,如CTLA-4、PD-1。近期的研究表明,人类癌症的“foreignness”很大程度上由其neoantigens的表达决定。DNA错配修复中PD-1抑制活性也与肿瘤的“foreignness”相关,这也是抗PD-1免疫疗法的决定因素。作者们表示,尽管肿瘤“foreignness”可能会在拥有非常高突变负荷的肿瘤中得到保证,但在中等或低水平突变负荷的情况下,只能推断肿瘤的“foreignness”,因此,还需更多这方面的解读。
2)General immune status
常规免疫状态的分析看似平凡,但可能与很多临床应用相关。研究表明,淋巴细胞数量的减少与黑色素瘤患者中CTLA-4抑制的不良效果相关。此外,嗜中性粒细胞/淋巴细胞的比率与患者接受免疫治疗后的疗效不佳也有关系,而嗜酸性粒细胞数量的增加可能与CTLA-4抗体对黑色素瘤患者的改善结果相关。另一方面,循环血液中骨髓源性抑制细胞(myeloid-derived suppressor cells)的数量似乎是免疫治疗结果的负面预测参数。
3)Immune cell infiltration
T细胞介导的肿瘤控制需要的一个明显条件是肿瘤反应T细胞(tumor-reactive T cell)浸润到肿瘤中。T细胞浸润的缺乏可能反应了肿瘤foreignness的不足、T细胞启动效率低或者T细胞吸引(attraction)缺乏。通过检测区分这些不同的可能性有望指导治疗的选择。
4)Absence of checkpoints
T细胞检查点及其对应配体的表达谱可能是非常有价值的生物标志物,因为它们不仅提供了特异性的治疗靶点,也提供了肿瘤特异性T细胞响应多方面的信息。在黑色素瘤中,PD-L1的表达与PD-1和CTLA-4抑制疗法的效果都相关。未来的研究方向包括进一步提高PD-L1作为生物标志物的价值。
5)Absence of soluble inhibitors
肿瘤炎症相关因子能够促进肿瘤的发展。研究表明,肿瘤相关炎症的肿瘤促进作用可以通过T细胞活性抑制进行调节。
6)Absence of inhibitory tumor metabolism
在健康的细胞中,有氧条件下,糖酵解后丙酮酸通常会进入三羧酸循环;缺氧条件下,丙酮酸则可在乳酸脱氢酶(lactate dehydrogenase,LDH)的催化下被还原为乳酸。然而,在癌细胞中,即便在足够氧存在的情况下,丙酮酸也能转化为乳酸。有研究表明,血清中LDH浓度过高与CTLA-4和PD-1抑制疗法的疗效不佳有很大的关系。
7)Tumor sensitivity to immune effectors
肿瘤细胞对免疫效应器的敏感性分析不仅能够用于鉴定患者对T细胞激活疗法的响应程度,还能够指明T细胞效应器的作用机制。
总结
理想的cancer immunogram的价值应该体现在回答以下这些问题上:免疫系统能够“看出”肿瘤是foreign吗?患者的免疫状态充分吗?有效应T细胞浸润到肿瘤中的证据吗?肿瘤细胞对T细胞响应敏感吗?要获得这些相关的信息需要进行肿瘤基因组学、免疫组织化学以及对外周血标准检测的联合分析。(生物谷Bioon.com)
DOI: 10.1126/science.aaf2834
相关会议推荐

2017”肿瘤免疫+”研讨会
会议时间:2017.3.10 -3.11 会议地点:上海
会议详情: http://www.bioon.com/z/2017tumor/