抗肿瘤纳米药物:百尺竿头,如何更进一步?
“迷你飞船”在血管中潜行,通过血管壁上的小孔潜入肿瘤组织,通过抗体识别并进入肿瘤细胞;一旦进入细胞,这些“飞船”便释放它们携带的货物——抗癌药物,摧毁肿瘤细胞:任务至此圆满完成。
早在21世纪初,这种关于纳米药物的设想就经常以动画片的形式向人们表明,纳米药物或将是对抗肿瘤的灵丹妙药,可以找到并进入肿瘤组织,将肿瘤细胞一网打尽。
然而,波士顿布莱根妇女医院的内科医生兼生物材料学家Omid Farokhzad却说,他现在一看到类似的视频,就感到非常尴尬。他解释道:“15年前,我们认为,如果将一些肿瘤靶向分子结合在纳米颗粒表面,它就可以进入肿瘤细胞。但是现在看来,这个想法非常幼稚。”
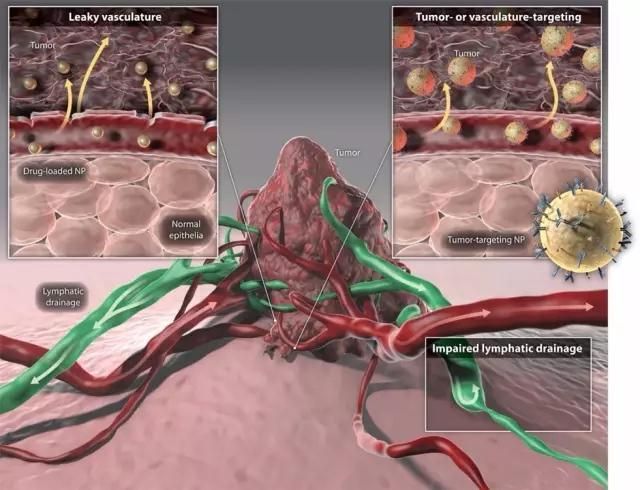
被动(左上)/ 主动靶向(右上)输送纳米药物,淋巴回流系统受损(右下)促使纳米药物在肿瘤部位滞留。(图片来源:Science Translational medicine)
从理论上讲,纳米药物可以往患者身体任何需要治疗的部位精准地输送一种或多种药物,不仅可以增强药物疗效,同时还可以避免传统化疗由于药物全身作用导致的副作用,而纳米药物所有这些优势都得益于纳米颗粒的大小。纳米药物领域一个最核心的假设就是:如果纳米颗粒足够小,它们就可以从肿瘤周围疏松多孔的血管泄漏到肿瘤组织中,但是这些颗粒又足够大,不会通过正常血管渗透进入正常组织。基于这样一种被动靶向的策略,这个领域已经有一系列成功的临床试验,它们都利用纳米颗粒携载药物,避免它们在心脏及其他非靶标部位积累,从而降低对正常组织的毒副作用。
与此同时,研究人员一直在尝试提高纳米颗粒针对肿瘤组织的主动靶向能力,但这更难实现。迄今为止,人类肿瘤复杂混乱的生物学特性使大多数努力都付之东流。
因此研究人员开始尝试新手段,他们根据纳米颗粒与细胞、组织相互作用的数据对纳米药物进行再造。他们也在竭尽全力研究为什么纳米药物对某些病人和肿瘤有效,对另一些却无效。在摆脱了这个领域不切实际的空想之后,纳米药物研究人员现在希望研发出一种名副其实的更有效的靶向治疗方法。
临床疗效喜忧参半
在刚刚过去的2016年,纳米药物领域遭受重创,似乎让纳米技术科学家们开始发自内心地自我反思。5月,由于临床试验结果令人失望,股票业绩不佳导致无力偿还债务,位于马萨诸塞州(译注:华人习惯称为麻省)剑桥市的一家世界顶级纳米药物公司——BIND Therapeutics宣布破产。这家由Farokhzad和MIT杰出化学工程师、企业家Robert Langer共同创立的公司,在创立之初就备受关注。观察人士对他们使用先进的化学工程及计算机自动设计技术进行高分子纳米颗粒设计的做法赞誉有加,这些技术可以让高分子纳米颗粒通过表面的肿瘤靶向分子,主动攻击肿瘤细胞。
纳米药物研究人员对BIND公司的策略报以很高的期望,结果却功亏一篑,让人扼腕叹息,然而随后5月发表的一篇关于纳米药物领域的荟萃分析综述论文给研究人员带来了更深的恐慌。多伦多大学纳米技术科学家Warren Chan和他的同事分析了过去10年、超过100篇关于纳米药物的文章,结果发现无论是否具有主动靶向能力,所有的纳米颗粒平均只有约0.7%的注射剂量进入肿瘤。Chan说:“这个效率低到让我吃惊,因为一谈到‘纳米’,人们立刻就会想到‘靶向’,这是纳米药物研究人员潜意识里的假设。”
当然这篇综述也受到了一些质疑。一些研究人员认为,这篇综述将不同肿瘤、不同药物及不同纳米颗粒的数据放在一起分析不合理。MIT的生物医学工程师Sangeeta Bhatia则认为,尽管不到1%的富集量听起来似乎并不多,但是“如果这么多的药物都在正确的细胞(即癌细胞)中,那也是非常有用的。”
也有人很认同Chan振聋发聩的呼吁:应该以更加令人信服的证据表明纳米颗粒是否可以显着提高药物的靶向输送效率,是否可以在临床病人身上产生显着疗效。迈阿密大学医学院的生物医学工程师Shanta Dhar认为:“对纳米药物领域的研究人员而言,Chan的统计结果展现了一个非常黑暗、悲观的事实,但是我们必须面对现实,并勇往直前。”
当然,2016年纳米药物领域也有一些好消息。例如6月爱尔兰都柏林Jazz Pharmaceuticals的子公司Celator宣布:他们一项使用纳米药物治疗急性髓性白血病的3期临床试验结果很乐观。这家公司将两种抗癌药物同时包载在脂质体纳米颗粒中,形成的纳米药物可以在一定程度上提高化疗药物抗癌疗效。马里兰州贝塞斯达美国国家癌症研究所肿瘤纳米技术研究中心主任Piotr Grodzinski解释说,由于这种癌症病人总生存率极低,因此哪怕一点小小的提高都值得关注。
Grodzinski认为,在缺乏传统治疗手段的疾病领域,纳米药物将大有作为:“纳米药物需要应用在那些以现有手段无法诊断或者治疗的疾病上。”
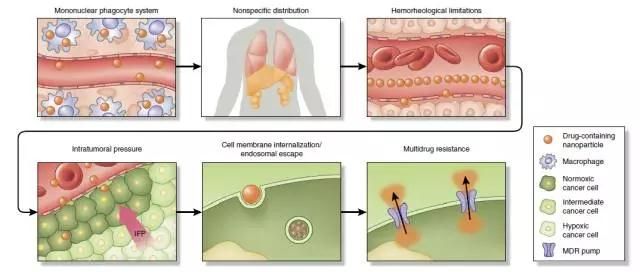
纳米药物体内输送屏障:单核巨噬系统吞噬、非特异性分布、瘤内压、血液流变学限制、细胞摄取及内涵体逃逸、多药耐药性(图片来源:Nature Biotechnology)
在适合的领域大显身手
耶鲁大学生物医学工程师Mark Saltzman认为恶性胶质瘤就是这样一种疾病。这种脑癌患者的生存率数据令人沮丧,大多数患者在确诊一年以内就会死亡。Saltzman希望设计一种可以靶向胶质瘤干细胞的纳米药物,因为在传统的化疗或放疗过程中,胶质瘤干细胞由于藏身于大脑深处而躲过一劫,并最终导致肿瘤复发,因此让药物到达大脑深部对治疗恶性胶质瘤至关重要。
然而将药物输送到大脑非常困难。大脑血管壁的细胞连接比机体任何其他循环系统都要紧密,从而形成了一种可以让物质选择性通过的结构——血脑屏障,它允许葡萄糖及其它必需营养物质通过,却可以阻挡毒素及纳米颗粒的进入。同时,大脑还擅长将已经进入其中的药物排出脑外。
坚固的血脑屏障使Saltzman放弃了传统的给药方式——将纳米颗粒注射到血液中让它们自己到达目标部位。相反,这位耶鲁的研究者试图绕到血脑屏障之后,直接将纳米颗粒注射到脑部组织液中,然后采用一种叫做对流增强传输的方式将药物送达大脑深处。这种方法需要在药物注射时施加一定的梯度压力,使脑部组织液形成对流,从而输送药物。
其他研究人员已经证明,这种方法可以提高脂质体纳米颗粒的输送效率,同时脂质体纳米颗粒也足够大,可以停留在大脑中避免被排出脑外。但是由于脂质体纳米颗粒不具有药物缓释的能力,Saltzman转而尝试一种由聚乳酸-羟基乙酸共聚物(Poly(lactic-co-glycolic acid),PLGA)制成的纳米颗粒。在手术缝合线和植入器械中,PLGA是一种常用的高分子。由于脑组织细胞间隙宽度和肿瘤组织细胞间隙一样,仅为几十纳米,因此Saltzman不得不用PLGA制备比以往更小的纳米颗粒,使其得以通过脑组织细胞间隙进入大脑深部。
2013年,Mark Saltzman的研究小组报道,70 纳米大小的PLGA纳米颗粒可以在大脑组织中扩散,同时还可以携载并释放药物。他们筛选了一系列抗癌药物,找到了可以有效杀伤胶质瘤干细胞的药物,并将它与纳米颗粒结合形成纳米药物,结果发现这种靶向脑部胶质瘤干细胞的纳米药物制剂可以使小鼠颅内的脑胶质瘤(由人脑胶质瘤干细胞生长而来)缩小。
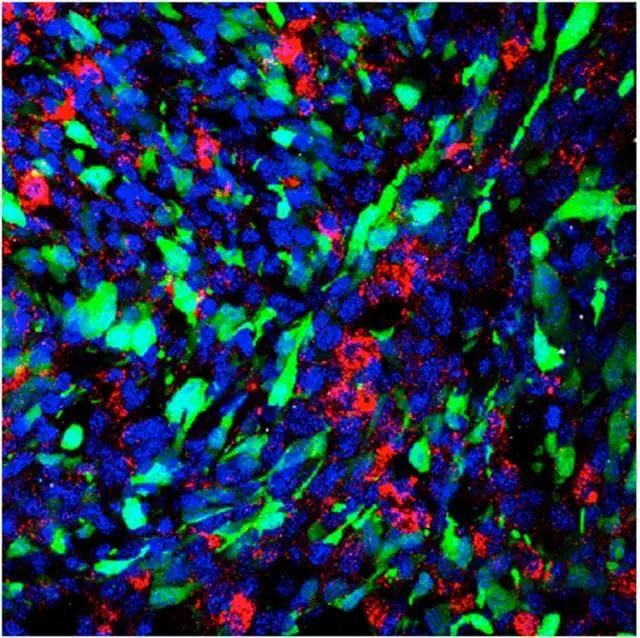
纳米药物治疗鼠脑胶质瘤:颅内注射的纳米颗粒(红色)被肿瘤细胞(绿色)吞噬,(图片来源:PNAS)
然而,小鼠的大脑比人的大脑要小得多。人大脑中的胶质瘤可以长到距离原发灶2 cm之外的区域,这意味着纳米颗粒需要扩散到很大的区域才会有效。在猪的大脑上进行的实验结果表明,这种对流增强药物输送的方式可以将纳米药物输送到约1000 mm3 的脑部组织内。目前,他们正在申请在学校的医学中心进行临床试验。
这种药物输送方法最吸引人的地方在于它可以输送任何需要进入大脑深层部位才能发挥药效的药物,它还允许药物以一种可控的方式随着时间缓慢释放,这是PLGA纳米颗粒的优势所在。如果这种脑部特异性输送体系在临床试验中展现出潜力,那么科学家可以用它输送新的抗癌药物或者其他神经毒性药物。Mark Saltzman说:“此前还没有人在肿瘤存在的情况下将纳米药物直接输入人的大脑中,因此,我们还有很多需要探索学习的地方,但是我们确信这种方法在动物身上确实有效。”
回归基础研究
Chan认为,每一个纳米药物领域的研究人员都应该尝试这种回归基础的研究方法。他认为纳米药物领域的研究人员应该着力于确定他们研究结果的可重复性,并针对纳米颗粒在人体内的作用方式进行基础研究。他解释说:“道理很简单,如果你不知道发电机的工作原理,就尝试制造汽车,那么造出来的汽车肯定开不了。如果你明白一个系统的工作原理,那你就可以改进它。”
目前这个领域的重大挑战依然很多。比如,一个最常见的问题就是蛋白会结合纳米颗粒并阻碍其发挥作用。“任何时候你将纳米颗粒注射到血液中,都会有许多蛋白微弱地结合在纳米颗粒表面,形成一层蛋白冠,”MIT的生物医学工程师Kim Hamad-Schifferli说道,“要制备出一种不形成蛋白冠的纳米颗粒是不可能的。”尽管纳米技术科学家们煞费苦心,在纳米药物载体表面结合了肿瘤靶向分子,但是这层蛋白冠会覆盖在这些靶向分子上,阻碍它们与受体结合,从而削弱靶向能力。
由于无法阻止蛋白冠形成,工程师们正在尝试如何使这层蛋白冠为我所用。Farokhzad认为能否控制蛋白吸附至关重要:纳米颗粒表面的蛋白可以影响纳米颗粒在血液中的循环时间、免疫系统对纳米颗粒的反应以及纳米颗粒的最终去向。结合蛋白的纳米颗粒要么通过肾脏排出,要么被一种叫做巨噬细胞的免疫细胞吞噬后进入肝脏、肺或者脾脏,这些都是无法避免的。Farokhzad正在系统研究纳米颗粒的尺寸对蛋白冠化学性质的影响,而一个合适的纳米颗粒很有可能通过吸附特定蛋白来引导其进入特定组织或者肿瘤。Hamad-Schifferli已经在体外研究中发现,蛋白冠可以改善纳米颗粒促进或者抑制凝血的性能。
Chan也一直在进行纳米颗粒体内命运的基础研究,他说:“我们正在尝试为人体设计纳米颗粒,但是我们却无法在人体内测试它们。”因此,他的实验室开始与多伦多大学医学中心合作,退而求其次,在病人离体样品上进行实验,如可以通过灌注营养液使刚切除的肿瘤存活足够长的时间,允许他们研究纳米颗粒通过这些肿瘤组织的方式。
对大多数生物材料研究人员而言,这样的研究很难独立完成,但是Chan认为,这些研究与临床试验很容易结合在一起。通过监控病人的临床反应,并将之与纳米药物通过病人肿瘤组织的信息结合在一起,纳米药物公司也许可以知道纳米药物是否发挥作用的原因,这些信息可以促进他们优化纳米颗粒。由于这种策略可以揭示人体肿瘤的基础信息,因此越来越多的研究人员开始使用这种研究策略。
分子影像让观察更精细
如果目标是马上提高临床疗效,也许有更容易的方法:使用分子成像技术揭示病人对纳米药物的接受程度。个性化医疗几乎成了所有癌症研究领域的指导思想,在纳米药物领域也得到越来越多的应用。任何乳腺癌患者在确定她的体内是否有结合赫塞汀的受体之前都不会使用赫塞汀。因此,如果一个病人的肿瘤本身就将纳米药物拒之瘤外,那么也就不能使用纳米药物对这个病人进行治疗。
位于马萨诸塞州剑桥市的Merrimack Pharmaceuticals公司正在使用一种磁共振成像(MRI)造影剂Ferumoxytol来检测纳米药物是否可以进入病人肿瘤组织。Ferumoxytol是美国FDA批准用于临床的含氧化铁纳米颗粒的MRI造影剂。他们推测,如果Ferumoxytol可以进入肿瘤组织,那么治疗性纳米药物也可以进入肿瘤组织。2014年,在圣地亚哥举办的美国癌症研究学会年会上,这家公司展示了他们在12个晚期癌症患者身上进行的一项先导试验结果:造影剂纳米颗粒可以进入的肿瘤也偏向于摄取他们的纳米制剂MM-398——一种包载抗癌药物伊立替康的脂质体。这家公司现在希望通过两个1期临床试验去验证该成像结果的预测效果:一个在患有乳腺癌或其他实体瘤的病人身上进行,另一个在患有转移性肿瘤或者是无法用手术切除的肿瘤病人身上进行。
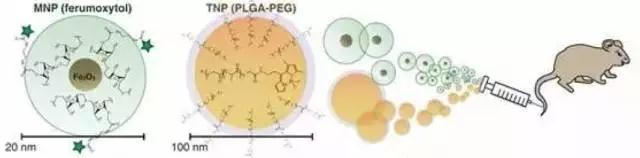
氧化铁纳米颗粒(左)预测纳米药物(右)治疗效果(图片来源:Science Translational medicine)
与此同时,日本东京大学的Kazunori Kataoka正在使用影像学技术更深入地研究被动靶向,目的是设计适合不同肿瘤以及不同肿瘤血管动力学的纳米颗粒。
Kataoka此前已经开发了四种纳米药物,目前正在进行临床试验,分别由日本千叶市纳米药物制造商Nanocarrier和东京跨国化学药物公司Nippon Kayaku负责,其中一种纳米药物正在胰腺癌病人身上进行3期临床试验,它可以响应肿瘤部位轻微偏酸的环境,促进药物快速释放。
在2016年2月发表的一项研究中,Kataoka转而重点研究了不同大小的纳米颗粒进入胰腺肿瘤的方式以及它们进入肿瘤时的情况。胰腺癌尤其难治,胰腺癌组织紧密,纳米颗粒很难进入其中。给小鼠注射不同大小的磷酸钙纳米颗粒后,Kataoka的团队在长达10小时的时间里,对小鼠的胰腺癌组织及肿瘤血管进行了每10分钟一次的连续成像。这些纳米颗粒不携带任何药物,但是在小鼠体内可以通过显微镜进行观察。
他们发现30 纳米左右的小纳米颗粒可以从血管渗透进入胰腺癌组织,但是大纳米颗粒仅仅通过血液随机的“纳米喷发”进入肿瘤组织。Kataoka认为:“纳米颗粒进入肿瘤的机理可能并不像人们此前认为的那么简单。”同时,小纳米颗粒可以进入肿瘤的紧密组织,但是大纳米颗粒(即使通过纳米喷发进入肿瘤)只能滞留在肿瘤外周。不过,他们在直肠结肠癌和卵巢癌肿瘤血管中并没有观察到类似“纳米喷发”现象,这些肿瘤血管更疏松,因而大纳米颗粒可以进入。这些信息提醒我们,针对胰腺癌应该选择小纳米颗粒,而针对其他肿瘤可能需要选择大纳米颗粒。Kataoka说,在合适的病人、合适的肿瘤中,理想的纳米药物能“像携载小战士的宇宙飞船一样发挥作用。”
Godzinski认为,像这种新的机理研究将帮助研究人员为不同肿瘤、组织及病人量体裁衣地设计纳米颗粒。认为纳米药物是一种可以轻松、精准地靶向肿瘤组织的纳米子弹的观念已经成为历史,但是,研究人员乐观地认为,基础研究可以帮助他们设计出新的纳米药物,使它们更接近科幻小说中的版本。
原文:Bourzac K. News Feature: Cancer nanomedicine, reengineered[J]. Proceedings of the National Academy of Sciences, 2016, 113(45): 12600-12603.
相关会议推荐

2017”肿瘤免疫+”研讨会
会议时间:2017.3.10 -3.11 会议地点:上海
会议详情: http://www.bioon.com/z/2017tumor/