抓住“潜逃”基因,科学家发现潜在的胃肠道癌症治疗靶标
像潜逃的银行抢劫逃犯一样,Gpr182 在几十年来伪装了各种身份:G10D,HrhAMR,Gamrh,7TMR,ADMR。它编码的蛋白质被称为“孤儿”受体,在细胞表面上并没有钥匙来进行解锁,这让科学家们束手无策。
1 月 20 日发表在《临床调查杂志》的一项研究中,科学家终于抓住了 Gpr182。虽然解锁 Gpr182 受体的关键仍然未知,但该研究表明,如果我们能找到一种方式来解锁 Gpr182,可以为胃肠道癌症的治疗打开一扇大门。
从药物角度看,这一实验结果是令人兴奋的,因为他们阐明了新的 G 蛋白偶联受体,这是一类非常适合药物开发的细胞膜蛋白质。约 40% 的获批药物靶向 G 蛋白偶联受体。这种新受体的发现可以更好地理解胃肠生物学,为改善对结直肠癌的治疗提供引导,这种疾病是美国癌症死亡的第二大主要原因。
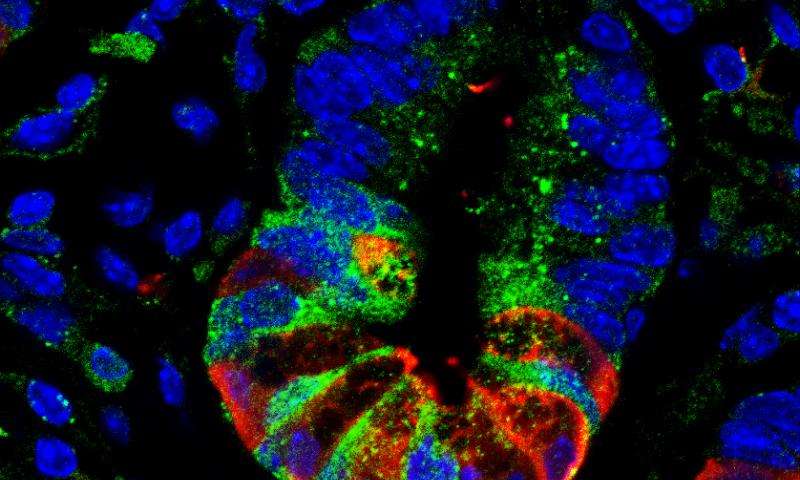
重新审视一个古老的谜
UNC 医学院 Kathleen Caron 长期从事与心血管健康有关的细胞功能的研究。引起她对 Gpr182 感兴趣的是一种常见的误解,它以往被证明是肾上腺髓质素的受体,被认为有助于心血管功能。科学家们在进行了几次大鼠研究后提出了这个概念,但它从未得到明确的证实。
该论文的资深作者 Caron 表示,在过去多年中,Gpr182 被称为肾上腺髓质素受体或 ADMR。即使现在,PubMed 数据库的搜索只有两篇论文涉及该基因。她的团队结合了小鼠模型和特殊的分子标记,研究 Gpr182 在不同发展阶段的小鼠的表达。
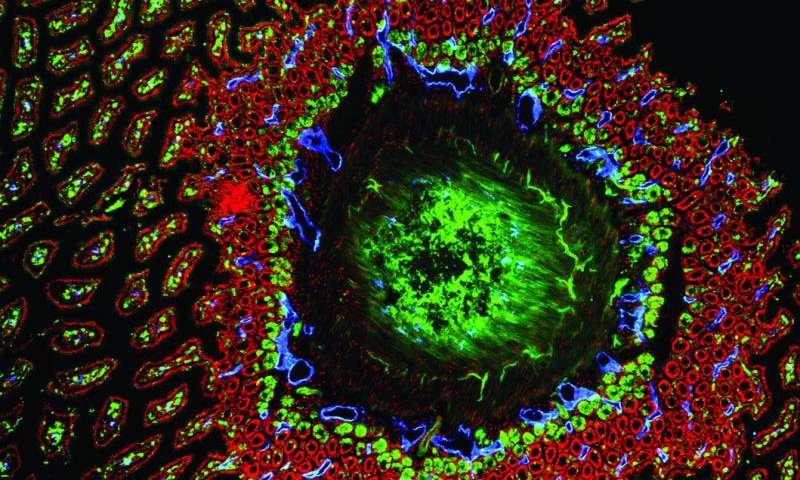
故事从小肠隐窝说起
实验结果显示 Gpr182 只在少数器官(包括肾,肺和心脏)的细胞表面上表达,特别的是,Gpr182 在小肠的管状凹陷(小肠隐窝)的干细胞中显著表达。
对于专注于心血管系统的实验室,这一发现会有点偏离目标。但是,该实验室的 Kechele 博士认为,这一发现很有价值。
Kechele 回忆道:“在本科阶段,我一直在胃肠实验室,看到肠道内的这个位置真的激起了我的兴趣。”
肠隐窝干细胞已经成为研究的焦点,因为它们代表了健康和癌症之间微妙平衡作用的极端。当食物通过胃肠道时,肠道中的细胞不断地脱落。肠道干细胞必须大量分化为肠道细胞以补充。
但这种快速增殖是有风险的:太少,薄弱的肠道容易引起感染;太多,肿瘤形成。了解肠干细胞用于调节细胞增殖的平衡点可以揭示癌症形成并提供新的治疗方式。 Kechele 想知道:Gpr182 是否是那些平衡点之一?
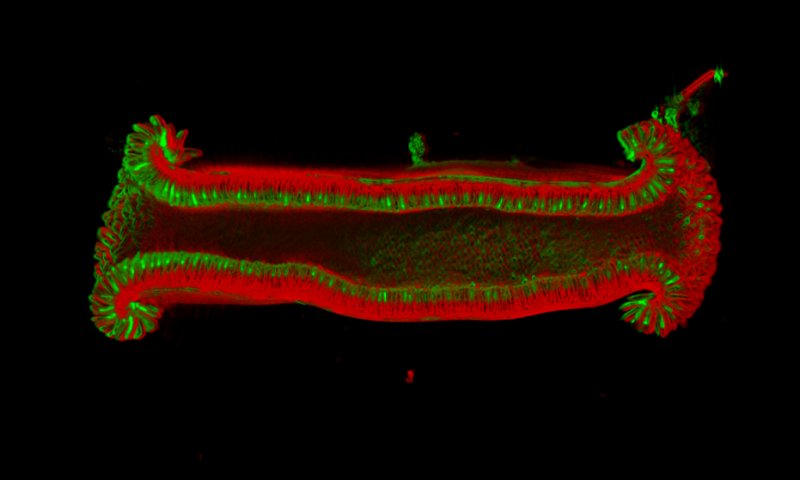
抑制增殖
研究人员发现当 Gpr182 被抑制时,细胞增殖趋于增加,表明 Gpr182 作为“抑制剂”来维持增殖速度。抑制 Gpr182 的突变可以导致细胞更快速地增殖,可能指向 Gpr182 与癌症之间存在联系。
Kechele 认为:“这种基因本身未必是癌症的驱动因素,但是它的基因突变可能在癌症中发挥重要作用。”
另一方面,抑制 Gpr182 在一些情况下可能是有益的。例如,当研究人员用放射线(模拟化疗或放射治疗期间发生的情况)消灭小鼠的活性肠干细胞群时,抑制 Gpr182,储备干细胞的增殖显著增加。
这种基因可能是治疗的潜在靶标,加速癌症治疗后肠道内膜的再生。通过减少 Gpr182 蛋白的表达,可以能够诱导干细胞在再生期更有力地反应,从而允许医生使用更高或更有效的治疗剂量,而不损害肠道的正常功能。
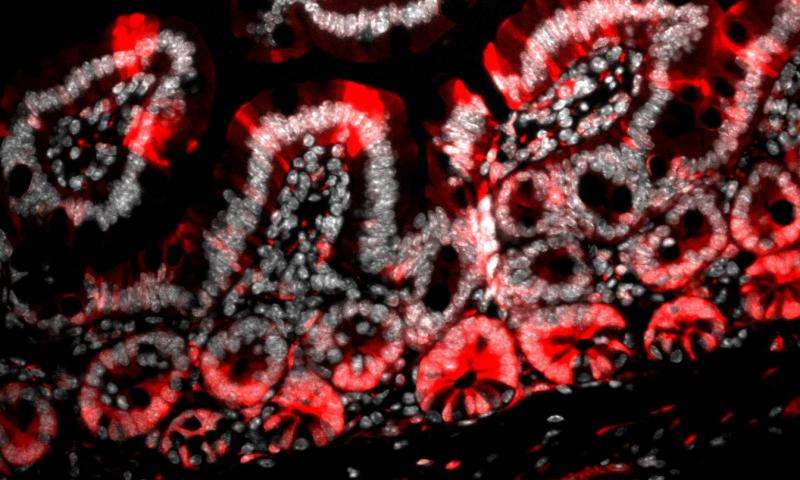
有前途的药物靶点
为了补充他们在小鼠中的研究,该团队还探测了 Gpr182 与人类癌症之间的联系。他们发现,与健康的结肠组织相比,结肠直肠癌患者的结肠中 Gpr182 的表达显著降低。进一步的分析显示在乳腺、肺和几种其他类型的癌症中 Gpr182 表达也出现减弱。
这些研究结果表明,操纵 Gpr182 表达或激活可以为癌症治疗提供新的途径,特别是对胃肠道癌症的治疗。一家制药公司 Omeros 宣称已经开发了一种与 Gpr182 相互作用的小分子,这种药物可以帮助加速药物开发。
原文链接:Orphan Gpr182 suppresses ERK-mediated intestinal proliferation during regeneration and adenoma formation