【世界抗癌日】盘点科学家们抗癌领域取得的突破性进展
2017年2月4日 讯 /生物谷BIOON/ --今天是第18个世界抗癌日,今年抗癌日的主题为“我们能,我能战胜癌症”,近年来全球很多科学家在癌症研究领域投入了大量精力去探索,同时也取得了突破性的成就,本文中小编就对近年来研究人员在抗癌研究领域取得的成果进行盘点,分享给各位!
【1】PNAS:重磅!研究人员开发出可同时靶向多靶点的抗癌药物
DOI: 10.1073/pnas.1613091114
MYC是一种调节基因,它控制着其他基因的表达,并编码涉及多个基本细胞过程的转录因子或者蛋白质。它也是癌细胞中最常见的突变基因,因此是癌症治疗中极具吸引力的靶点。
同时MYC又被证明是一个很复杂且难研究的治疗性药物靶点。在一项最近发表在《PNAS》上的新研究中,来自加州大学圣地亚哥分校(UCSD)医学院和摩斯癌症中心的研究人员与雷迪儿童医院、科罗拉多大学医学院及一家圣地亚哥的生物制药公司的同事合作,开发了一种有潜力的新型抗癌药物,它可以同时抑制两个或者多个分子靶点,将药物疗效和安全性最大化。
“许多抗癌药物只有一个靶点,它们只做一件事情,如抑制一个受体或者信号通路。”论文共同资深作者、UCSD医学院儿科教授Donald L. Durden博士说道,“这篇文章描述的药物作用模式与现有的一个药物针对一个靶点的作用模式完全不同。”
【2】PNAS:突破!科学家发现抗癌新方法!
doi:10.1073/pnas.1611299114
日前,来自南安普敦大学的研究人员通过研究发现了机体免疫系统能够识别并且有效抵御癌症的重要途径,相关研究刊登于国际杂志Proceedings of the National Academy of Sciences上。
文章中,研究者发现了一种名为Akt的关键蛋白,该蛋白对于机体识别癌症的途径非常关键,机体的免疫系统中包括毒性T细胞,这种类型的T细胞能够主动寻找并且摧毁机体感染或者癌症,当毒性T细胞处理机体面临的危险时,大部分细胞都会死亡,剩下的T细胞就会转化成为记忆细胞,当相同危险再次袭击机体时这些记忆细胞就会发挥作用,但如今研究人员并不清楚这些记忆细胞发挥作用的分子机制。
研究人员表示,这种名为Akt的蛋白质对于记忆T细胞的数量和类型有着巨大的影响,当毒性T细胞转化成为记忆T细胞时Akt蛋白对于记忆T细胞的生存非常关键,同时其对于记忆T细胞是否能够有效应对未来机体所面临的威胁也至关重要。Al-Shamkhani教授说道,如果我们能够有效调节Akt蛋白来增强记忆T细胞的数量和能力的话,我们或许就能够有效帮助机体抵御癌症的发生。
【3】Science子刊:揭示出癌症免疫疗法新靶标---TNFR2
doi:10.1126/scisignal.aaf8608
在一项新的研究中,来自美国麻省总医院(MGH)的研究人员发现新的证据证实肿瘤坏死因子受体II(TNFR2)可能是免疫肿瘤学疗法(诱导病人免疫系统抵抗癌症)的一种主要靶标。TNFR2在很多类型的癌细胞和免疫抑制性的调节性T细胞(Treg)的表面上表达。Treg细胞浸润到肿瘤中,抑制免疫系统活性。相关研究结果发表在2017年1月17日那期Science Signaling期刊上,论文标题为“Targeting TNFR2 with antagonistic antibodies inhibits proliferation of ovarian cancer cells and tumor-associated Tregs”。
论文通信作者、MGH免疫学实验室主任Denise Faustman博士说,“一段时间以来,我们已知TNFR2在肿瘤微环境(特别是非常重要的Treg细胞群体)中高度表达,但是我们如今正开始理解通过细胞表面癌基因TNFR2靶向癌细胞的潜在疗效。”
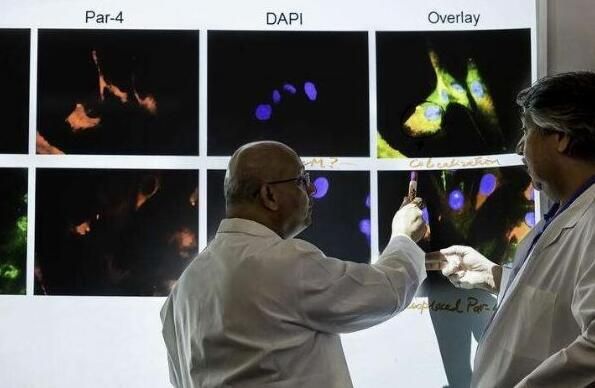
【4】Cell Rep:重磅级发现!抗疟疾神药氯喹或能有效治疗癌症
doi:10.1016/j.celrep.2016.12.051
日前,一项发表在国际杂志Cell Reports上的研究报告中,来自肯塔基大学Markey癌症中心的研究人员通过研究发现,一种用于治疗疟疾的药物—氯喹或能够有效治疗转移性癌症患者。在临床试验中,研究者发现,氯喹能够诱导小鼠模型和癌症患者机体中肿瘤抑制蛋白Par-4的分泌,而蛋白Par-4的分泌对于肿瘤细胞死亡以及肿瘤转移的抑制非常关键。
研究者表示,氯喹能够通过依赖p53激活的经典分泌通路来诱导Par-4分泌,p53能够直接诱导Rab8b激活,Rab8b是一种GTP酶,其对于Par-4运输到质膜非常重要,本文研究结果表明,氯喹能够诱导正常细胞分泌p53和Rab8b依赖性的Par-4,从而就能够对转移性肿瘤生长进行Par-4依赖性的抑制。
研究人员Rangnekar说道,由于p53在肿瘤中经常会发生突变,其就会使得肿瘤对疗法产生耐受性,然而本文研究中我们发现,一种FDA批准的名为氯喹的药物就能够激活表达p53的正常细胞,使其分泌Par-4来阻断p53缺失的肿瘤进行转移。
【5】PNAS:突破!科学家阐明有效抵御癌症发生的新机制
doi:10.1073/pnas.1614684114
最近,来自邓迪大学和巴斯大学的研究人员通过研究发现,一种名为“分子体积控制”( molecular volume control)的技术未来或有望对酶类活性操控,进而控制癌症的发生和治疗方法,相关研究刊登于国际杂志PNAS上。文章中,研究者揭开了酶类—双特异性磷酸酶5(DUSP5)的新功能,这或许能够帮助研究者更好地理解肿瘤发生的分子机制。
DUSP5酶类被认为能够关闭另外一种ERK酶的活动,而ERK酶能够控制多种癌症中肿瘤细胞的生长,包括结肠癌、肺癌和黑色素瘤等,这就表明,DUSP5或许是一种肿瘤抑制蛋白,但目前很多研究者都发现在多种人类癌症中能够发现DUSP5酶类活性的增加。
利用基于细胞的模型,研究者研究发现,DUSP5的缺失能够通过驱动ERK酶至较高水平来完全阻断癌细胞形成,而当ERK酶达到较高水平时就会参与到细胞中的一种天然保护机制中,这就类似于听收音机一样,当音量过高或过低时往往就会影响听众的收听效果,类似地,增加或降低细胞中DUSP5的水平或许就会使得ERK酶的水平要么过高要么过低,进而就会诱发癌症的发生。
【6】Angew Chem:中美科学家提出癌症协同治疗新方法
doi:10.1002/anie.201610682
如今,装载着一种氨基酸而配备着一种酶的生物相容性纳米胶囊将两种抗肿瘤策略结合到一种协同治疗概念中。研究人员希望这会增加疗效和降低副作用。在一项新的研究中,他们解释了这一概念:肿瘤细胞被剥夺它们的营养物葡萄糖,这是因为它被转化为毒性的一氧化氮(NO)和过氧化氢(H2O2)。相关研究结果于2016年12月9日在线发表在Angewandte Chemie期刊上,论文标题为“Glucose-Responsive Sequential Generation of Hydrogen Peroxide and Nitric Oxide for Synergistic Cancer Starving-Like/Gas Therapy”。
NO是一种毒性的能够导致烟雾的气体。然而,在体内,当浓度较低时,它是一种重要的信使分子,调节着循环和性欲等功能。它也是一种重要的抵抗真菌和细菌的防御武器。在较高浓度时,NO能够杀死肿瘤细胞,并且增加光动力疗法和放疗的疗效。就临床使用而言,在靶区域中,NO需要由一种生物相容性前体分子释放出来。
【7】Nat Chem Biol:靶向性癌症疗法取得突破性进展
doi:10.1038/nchembio.2253
真正的靶向性癌症疗法的最大挑战就是癌症对免疫系统的抑制,近日来自美国西北大学的研究人员通过研究开发了一种新方法,其能够对免疫细胞进行“重新布线”来逆转免疫系统被抑制的状态,相关研究刊登于国际杂志Nature Chemical Biology上。
研究者Joshua N. Leonard表示,如今癌症疗法最有前途的领域就是免疫疗法,就是通过调节机体免疫系统来抵御一系列癌症,而对简单细胞的“重新布线”最终或许就能够帮助克服肿瘤位点的免疫抑制作用。当机体癌症存在时,肿瘤位点分泌的分子就会促进很多免疫细胞失活,文章中研究人员则对人类机体的免疫细胞进行遗传性改造使其能够感知周围环境中肿瘤分泌的分子,并且变得更具活性来对肿瘤细胞产生反应。
这种特殊功能在临床上非常有吸引力,而且同癌症免疫疗法相关,重新改编细胞“输入”和“输出”功能的常规方法或许就能够帮助抵御包括癌症在内的多种疾病。Leonard指出,这项研究中我们受到了临床观察的启发,当然我们或许也知晓机体中出错的地方并且对其进行修正,但我们缺少工具将这些结果转化成为开发疗法,随着本文新技术的开发,我们首先对细胞功能进行了分析研究,随后我们就能够构建出一种行使特定功能的细胞。
【8】Nature:突破性进展!新型靶向性药物或可有效遏制癌症发展
doi:10.1038/nature20554
最近,一项刊登于国际杂志Nature上的研究报告中,来自路德维格癌症研究所的研究人员通过研究发现,一种临床试验中的实验性药物或可有效逆转“讨厌”细胞的行为,这种“讨厌”细胞(抑制性细胞)能够抑制机体免疫系统对肿瘤发起攻击,同时研究者还发现,这些抑制性细胞能够干扰免疫检查点抑制剂的效力,从而就会促进机体命令免疫T细胞释放对癌细胞的攻击行为。
研究者Taha Merghoub说道,当免疫检查点抑制剂发挥作用时其就会产生持久的效应,但并不是所有的患者都会对疗法产生反应,部分原因或许是某些肿瘤含有一些肿瘤相关的骨髓细胞(TAMCs),其能够抑制T细胞对肿瘤细胞的攻击。这项研究中,研究者利用癌症小鼠模型进行研究发现,利用一种合适的靶向性疗法或许就能够逆转TAMCs的效应。
【9】Nat Med:重磅!科学家组合四种策略 借免疫之力重创癌症
doi:10.1038/nm.4200
借助机体自身免疫系统摧毁肿瘤是一个令科学家们非常着迷的研究方向,人们已经开始意识到这一策略中蕴藏的巨大潜力。来自美国MIT的一项最新进展或将肿瘤免疫治疗策略再推进一步。
在这项新研究中,研究人员将四种不同的治疗方法进行联合,激活免疫系统的两个分支,产生协调攻击攻击效果完全清除了小鼠模型体内的肿瘤。这种方法可以用来靶向许多不同类型的癌症,也能让免疫系统“记住”它们的攻击目标,摧毁最初治疗后新出现的癌细胞。
相关研究结果发表在国际学术期刊Nature Medicine上。
肿瘤细胞通常会分泌一些化学物质抑制免疫系统,导致免疫系统很难依靠自身力量对肿瘤发起攻击。而目前大多数的抗肿瘤免疫研究都只聚焦在免疫系统的两个分支——固有免疫和适应性免疫二者当中的一个。
【10】Nature:突破!科学家开发出可治疗多种类型癌症的新型化合物
doi:10.1038/nature19830
最近,一项刊登于国际杂志Nature上的研究报告中,来自澳大利亚沃尔特与伊丽莎-霍尔研究所(Walter and Eliza Hall Institute)的研究人员通过研究表明,一种特殊的化合物能够有效阻断一种关键蛋白的作用,而这种蛋白对于维持至少四分之一癌症的持续性发展非常关键,相关研究或可帮助研究人员开发新型方法来有效杀灭癌细胞,并且开发治疗诸如急性髓性白血病、淋巴瘤及其多种实体瘤(黑色素瘤等)等癌症的新型疗法。
Servier公司所发现的这种名为S63845的化合物能够靶向作用BCL2家族蛋白MCL1,该蛋白对于癌细胞的持续性生长非常必要;研究者Lessene指出,抑制MCL1蛋白或可有效靶向作用多种类型的癌症。MCL1蛋白对于很多癌症都非常重要,因为其是一种促生存的蛋白,能够让癌细胞逃过程序性细胞死亡过程,对癌症模型进行的大量研究结果表明,化合物S63845能够有效地靶向作用依赖MCL1蛋白存活的癌细胞。(生物谷Bioon.com)