Nat Cell Biol:我国科学家利用癌症自己的代谢机制开发出一种新的肿瘤靶向系统
图片来自Nature Chemical Biology, doi:10.1038/nchembio.2297
2017年2月19日/生物谷BIOON/---在一项新的研究中,来自中国苏州大学、中国科技大学、中科院长春应用化学研究所和美国伊利诺伊大学厄巴纳-香槟分校的研究人员利用癌细胞自己的代谢机制,发现一种新的肿瘤靶向方法:利用小分子糖标记和靶向仍未充分了解的癌症。这可能为治疗对常规的靶向抗体不作出反应的癌症(如三阴性乳腺癌)打开大门。相关研究结果于2017年2月13日在线发表在Nature Chemical Biology期刊上,论文标题为“Selective in vivo metabolic cell-labeling-mediated cancer targeting”。论文通信作者为伊利诺伊大学厄巴纳-香槟分校材料科学与工程系的Jianjun Cheng教授、苏州大学功能纳米与软物质研究院江苏省碳基功能材料与器件高技术研究重点实验室的殷黎晨(Lichen Yin)教授和中科院长春应用化学研究所生态环境材料重点实验室的博士生导师陈学思(Xuesi Chen)博士。
靶向癌症疗法依赖于癌细胞表面上的特异性标志物。科学家们能够设计抗体来寻找这些标志物和运送治疗试剂或显像剂。然而,一些癌症不适合利用这种疗法加以治疗,这是因为它们缺乏可供靶向的表面标志物。
Cheng教授说,“比如,我们想要靶向三阴性乳腺癌。这是一种致命性的乳腺癌,具有较低的存活率。迄今为止,我们没有任何针对这种癌症的靶向疗法,这是因为在它的表面上没有我们在正常情形下能够靶向的受体。我们的问题是,我们能够构建一种人工受体吗?”
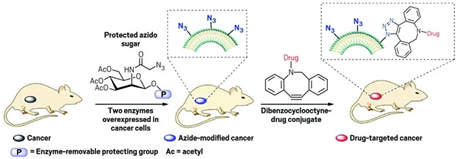
这些研究人员发现一种解决这个问题的方法:利用一类被称作N-叠氮-乙酰甘露糖胺(N-azidoacetylmannosamine, ManAz)的小分子糖标记癌细胞。一旦在这些癌细胞中代谢,它们就在癌细胞表面上表达,而且能够被DBCO分子靶向。
Cheng教授说,“这非常像是钥匙插入锁中。它们彼此间是非常特异性的。DBCO和ManAz彼此间高度特异性地发生反应。我们称它为点击化学(click chemistry)。关键的问题是你如何将ManAz刚好添加到肿瘤表面上?”
为了确保ManAz仅在癌细胞的表面上表达,这些研究人员将一种保护性基团(乙酰基)添加到ManAz上,产生四乙酰基-N-叠氮-乙酰甘露糖胺(tetraacetyl-N-azidoacetylmannosamine, Ac4ManAz)。这种保护性基团能够被肿瘤特异性的酶移除。在正常的组织中,Ac4ManAz简单地穿过。在肿瘤细胞中,它被完全代谢,在癌细胞表面上表达,从而产生DBCO特异性的靶标(即ManAz)。与抗癌药物或显像剂偶联在一起的DBCO通过与ManAz特异性地发生反应,从而将这种药物或显像剂运送到癌细胞中。
这些研究人员在结肠癌、三阴性乳腺癌和转移性乳腺癌的模式小鼠体内测试了这种基于ManAz的靶向系统。
Cheng教授说,“我们发现相比于其他的组织而言,这些肿瘤具有非常强的信号。我们首次在体内利用小分子糖标记和靶向肿瘤,而且我们是利用癌细胞自己的代谢机制来实现这一点的。”(生物谷 Bioon.com)
原始出处:
Hua Wang, Ruibo Wang, Kaimin Cai et al. Selective in vivo metabolic cell-labeling-mediated cancer targeting. Nature Chemical Biology, Published online 13 February 2017, doi:10.1038/nchembio.2297.