基于生物分子组装的仿生光合成和抗肿瘤治疗研究获系列进展
多尺度分级有序组装是生物体中普遍存在的一种现象。生物内源分子包括肽和蛋白质等均能通过分子间多种弱相互作用(如氢键、静电力、范德华力、π效应和疏水作用等)的协同,自组装形成各种多尺度有序结构,为生物体提供多样化的功能。对多尺度分级有序组装的研究,一方面有助于人们在分子水平上认识自然界中生命起源、形成和演化的过程;另一方面也为新材料的合成以及生物新技术的开发提供了新的思路和手段。然而,如何通过弱相互作用的协同和调控,实现生物分子(尤其是生物小分子如寡肽)可控组装,构建仿生的多尺度分级有序功能体系仍是一个长期的挑战。
在国家自然科学基金委、中组部和中国科学院的大力支持下,中国科学院过程工程研究所研究员闫学海团队在基于生物分子组装的仿生光合成和抗肿瘤治疗方面取得系列进展。研究人员受天然蛋白质调控色素分子自组装的启发,提出了寡肽调控卟啉自组装构建仿生功能体系的策略。通过对寡肽亲疏水性的合理设计,实现了分子、纳米和微米尺度有序自组装结构的构建,获得的长程有序自组装纤维束具有光学各向异性、手性放大、大斯托克斯位移、增强的光稳定性和光催化活性等特性(Angew. Chem. Int. Ed. 2015, 54, 500–505)。
进一步研究表明,这种寡肽调控卟啉自组装的过程在模拟火山热液的环境中能够高效地进行,获得的多尺度组装结构在酸性、高温和高盐的条件下稳定,并且能够通过原位矿化整合二氧化钛和铂纳米颗粒。杂化组装体中卟啉和纳米颗粒的有序排布与绿色硫细菌中绿色体和反应中心蛋白的组织形式类似,实现了在苛刻条件下的光催化产氢(Angew. Chem. Int. Ed. 2016, 55, 12503–12507,图 1)。因此,肽调控卟啉自组装的多尺度有序结构一定程度上模拟了生物光合成系统,为研究原始光合成系统的形成提供了参考,并对仿生生物能源体系的构建具有重要指导意义(Adv. Mater. 2016, 28, 1031–1043)。
肽调控功能分子的自组装,不仅为仿生生物能源提供了一种新的思路,也为纳米药物的构建提供了一种新的策略。针对光动力治疗中光敏剂药物递送效果差的问题,研究人员通过分子间弱相互作用的协同和调控,实现了寡肽分子对光敏剂的可控组装,获得的光敏剂纳米药物稳定性好、载药量高、具多重响应性释放和肿瘤选择性富集等优点,在小鼠体外和体内抗肿瘤治疗中起到了良好效果(Angew. Chem. Int. Ed. 2016, 55, 3036–3039)。寡肽分子具有生物安全性好、无免疫原性的优点,以其调控药物分子自组装有望获得高效抗肿瘤纳米药物(Adv. Mater. 2017, DOI: 10.1002/adma.201605021)。在最近的工作中,他们设计、合成了寡肽和卟啉的共价复合物,这种新型的复合物在水体系中能自发组装形成粒径 25 nm 左右的纳米点。组装过程中卟啉在π效应作用下形成 J - 聚集结构,而肽分子不仅通过亲水作用为纳米点提供了在水环境中的良好分散性,而且通过与卟啉的π作用阻止了纳米点的进一步生长,实现了长期的胶体稳定性。由于纳米点中卟啉处于高度聚集状态,其吸收的光能通过荧光或光化学失活的途径被抑制,增强了其光热转换效率。纳米点在肿瘤的光热治疗中展现了优良的肿瘤富集和肿瘤杀伤性能,首次实现了肽调控自组装光热纳米粒子的构建和抗肿瘤治疗应用,为以超分子科学设计治疗性的纳米组装药物提供了新的思路(J. Am. Chem. Soc., 2017, 139, 1921–1927,图 2)。
基于该研究团队在肽自组装和功能调控方面的系列研究,英国皇家化学会发表了题为《肽自组装:热力学与动力学》的 Critical Review(Chem. Soc. Rev., 2016, 45, 5589–5604),系统评述了肽自组装中热力学和动力学调控的重要性和相关进展,并展望了肽基多尺度分级有序组装和功能调控领域的未来发展方向(图 3)。
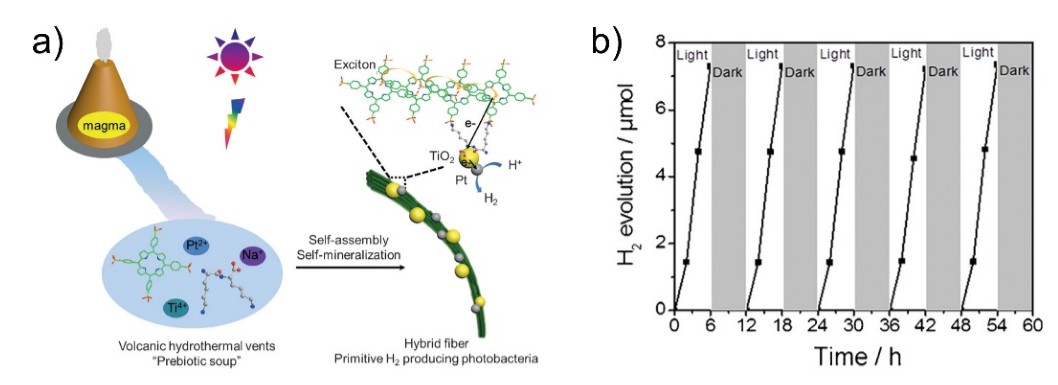
图 1 肽调控卟啉自组装结合原位矿化构建仿生光合成系统:a) 组装体构建示意图;b) 组装体可实现持续的光催化产氢。
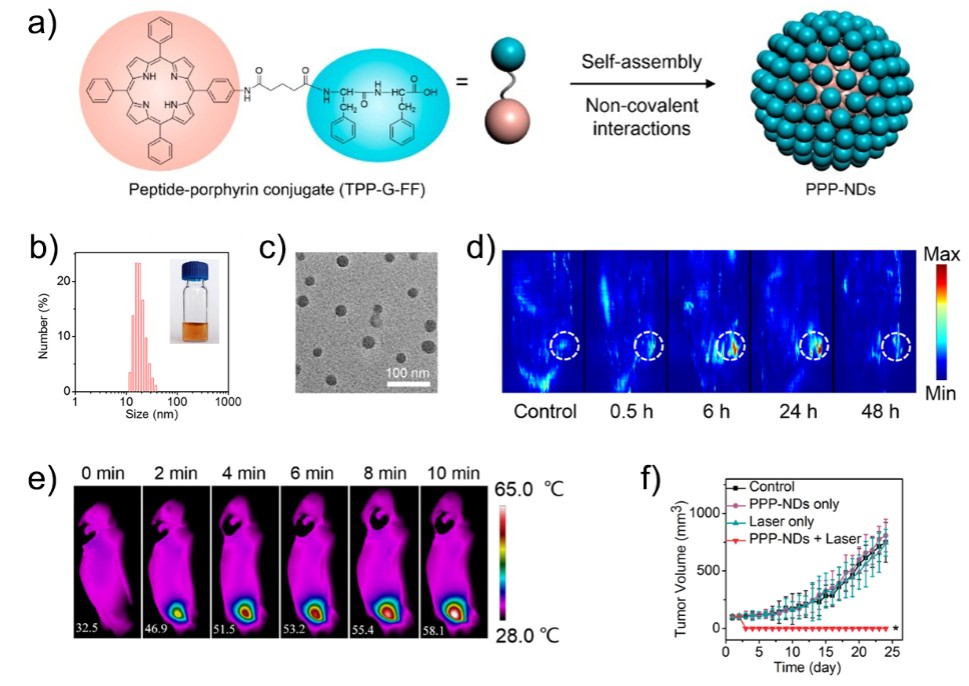
图 2 基于肽 - 卟啉自组装的光热纳米点(PPP-NDs):a) 分子结构和自组装示意图;b) 粒径分布图;c) 透射电子显微镜图;d) 纳米点小鼠体内光声成像图;e) 纳米点用于光热治疗时小鼠热成像图;f) 纳米点用于光热治疗时小鼠肿瘤生长曲线。

图 3 肽自组装:热力学与动力学(Chem. Soc. Rev., 2016, 45, 5589–5604)