癌症表观遗传学:发现白血病关键蛋白
科学家们发现,调控蛋白 ENL 能促进白血病的发生。这加深了学界对转录调控的理解,并提示了一种潜在的白血病疗法。
血液肿瘤的发病原因通常是染色体易位,产生由两个蛋白质的片段连接形成的融合蛋白,最终引起疾病。调节蛋白混合性白血病(regulatory protein mixed lineage leukaemia, MLL)中的融合蛋白通常也存在于侵袭性儿童白血病中,并且与不良预后有关。因此,开发基于 MLL 重排(MLL-rearranged, MLL-r)融合蛋白的白血病治疗策略非常必要。在《自然》(Nature)杂志中,Erb 等人 he Wan 等人指出,ENL 蛋白是影响白血病中 MLL-r 细胞存活能力的关键因素。
细胞中包裹 DNA 的组蛋白是结构和信号因子。添加或去除组蛋白上的分子基团修饰,可以调节基因表达。 ENL 蛋白的一个显着结构特征是具有一个由大约 75 个氨基酸折叠而成的结构域——YEATS 结构域。该结构可以读取组蛋白上的乙酰化修饰——机制是识别和结合组蛋白中有乙酰基修饰的赖氨酸残基。Erb 等人和 Wan 等人提供的证据非常扎实,表明 ENL 对乙酰化组蛋白的这种 “读取” 能力对诱导 MLL-r 白血病至关重要。
MLL 融合蛋白主要是涉及表观遗传调控(独立于 DNA 序列的基因表达调节方式)的两个蛋白复合物。第一个是 SEC(super elongation complex, SEC),其促进转录延伸的基因转录阶段。第二种是 DotCom(DOT1L-containing complex, DotCom),其将甲基添加到组蛋白 H3 上的赖氨酸 79 残基(缩写为 H3K79)。产生这些融合的染色体易位通常发生在哺乳动物中两组染色体中的一组上。
普遍的观点是 MLL 融合蛋白促进 SEC 和 DotCom,以及两条易位染色体编码的其它蛋白(包括融合和正常非融合蛋白)定位到它们促进表达的基因处,从而促进白血病发生。
Erb 等人和 Wan 等人发现了 SEC 和 DotCom 稳定性的另一个互补机制。他们发现,ENL 的失活削弱了 MLL-r 细胞中 SEC 和 DotCom 的功能。ENL 与 SEC、DotCom 结合的能力提示了一种模型——ENL 通过 YEATS 结构域,识别乙酰化 H3,增强 SEC 和 DotCom 复合体与 DNA 结合的稳定性,并调节基因组异常区域的活性(图 1)。
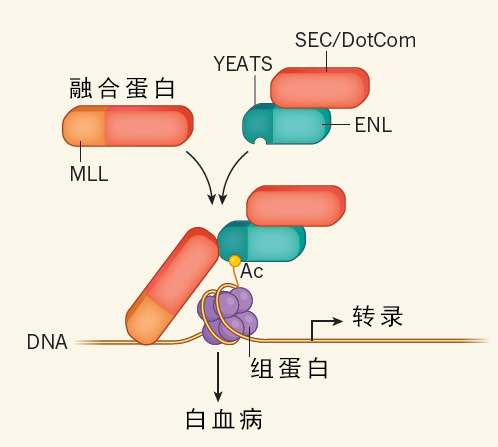
图 1 蛋白质 ENL 对于 MLL-r 白血病至关重要。一些白血病中存在着一些由部分 MLL 蛋白和另一种蛋白的一部分混合而成的蛋白。第二种蛋白通常是 SEC(super elongation complex)蛋白复合体或 DotCom(DOT1L-containing complex)的一部分。这两种蛋白复合体都调节 MLL-r 白血病(完整和部分融合的 SEC / DotCom 复合体在图中以红色标出)中的基因转录程序。 ENL 蛋白与两种复合物结合,同时在细胞中该复合体与 MLL 融合,ENL 既能和未融合的 SEC/DotCom 互动,又能与融合的 SEC/DotCom 互动。ENL 包含一个可以识别组蛋白 H3 上的特定乙酰基(Ac)的 YEATS 结构域。Erb 等人和 Wan 等人证实,ENL 蛋白的 YEATS 域有助于稳定 SEC 和 DotCom 与 DNA 的结合,促进驱动白血病方式的基因表达。
这种新模型提出了一种可能性,靶向 ENL YEATS 结构域的小分子抑制剂等药物可以选择性杀死白血病 MLL-r 细胞。其它细胞类型似乎可以很大程度上地耐受 ENL 损失,但是 SEC、DotCom 和 ENL 在多种细胞中均有表达,所以在开发这类药物时,非常重要的一点就是要理解这种耐受性上的差异。
在 MLL-r 白血病中,ENL 的重要性与多项研究一致。这些研究显示,DOT1L 活力调控不良是 MLL-r 细胞的存活和增殖所必须的。长期以来,H3K79 甲基化一直与基因转录活力相关,并且是控制 DOT1L 活性的调节机制。一个关键的未获解答的问题是,这些组蛋白修饰是如何直接影响转录的。
甲基—赖氨酸信号通常通过与 YEATS 结构域读取甲基化修饰类似的机制,与下游过程相偶联。除了 H3K79 外,所有主要组蛋白甲基化位点的阅读器结构域都已被识别。此外,甲基化赖氨酸可以通过脱甲基酶来动态调节,但是去除 H3K79 处甲基的脱甲基酶还有待鉴定。Erb 等人和 Wan 等人的研究进一步鼓励了研究人员去识别和鉴定 H3K79 甲基化的 “读取器” 和脱甲基酶,因为这些酶与 ENL 介导的信号通路交叉,也可能成为 MLL-r 白血病的治疗靶点。
目前有一种新的理论认为,表观遗传调节因子可以在疾病中发挥重要作用。在这种意识的驱动下,越来越多的学者和企业致力于开发这些机制的抑制剂来治疗癌症。已有 MLL-r 白血病的临床试验评估了 DOT1L 抑制剂(详见 go.nature.com/2lquysj)。有趣的是,Erb 等人发现,在细胞模型中,使用 DOT1L 抑制剂,外加敲入不能识别乙酰化赖氨酸的 ENL 突变基因,相比于单用这两种方法,抑制驱动白血病发生的基因表达程序的效果更强。这表明,这两种疗法之间存在协同作用。
Wan 等人还研究了组合疗法治疗 MLL-r 白血病的潜力,联用靶向 ENL YEATS 结构域和赖氨酸乙酰化的另一个读取器—BET 家族蛋白的溴结构域。BET 蛋白通常与 SEC 相互作用。并促进转录延伸。BET 抑制剂破坏了 BET 蛋白与乙酰基—赖氨酸部分的结合,并且目前有约 20 个临床试验测试这些药物在癌症治疗上的功效。Wan 等人发现,ENL YEATS 结构域的抑抑制剂与 BET 抑制剂 JQ1 的联用,对 MLL-r 白血病细胞具有高度毒性。
这些组合疗法的效果表明,多个组蛋白修饰信号共同作用,形成 MLL-r 白血病的特有表观遗传状态。因此,多头靶向疗法的疗效更强,且可减少耐药性的出现——这是单药物疗法的风险之一。
一直以来,药物开发者主要聚焦于靶向酶活性,而非蛋白质—蛋白质相互作用。然而,靶向多个表观修饰基团 “读取器” 疗法的开发变得越来越流行,这部分得益于 BET 抑制剂取得的成功。YEATS 结构域的结合位点也是一个非常有吸引力的药物开发靶标。因此,Erb 等人和 Wan 等人关于 ENL 的发现不仅加深了我们对细胞如何整合与转录相关的信号的理解,而且为治疗复杂疾病提供了新的启示。
原文检索: Alex W. Wilkinson & Or Gozani. (2017) Cancer epigenetics: Reading the future of leukaemia. Nature, 543(1038): 186-188.