克服“乏氧耐受”—实现精准高效的肿瘤治疗
癌症即恶性肿瘤是当前威胁人类生命健康的几种重大疾病之一。尽管人类对癌症的发生机制和治疗方法已经有了数十年的深入研究,然而日趋庞大的癌症新增癌症病例和高居不下的死亡率依然对肿瘤治疗提出了巨大的挑战。因此,发展新型癌症治疗手段,实现安全、高效的肿瘤治疗已成为当前众多学科研究的热点问题之一。近日,苏州大学刘庄教授团队与澳门大学陈美婉教授和美国威斯康星大学麦迪逊分校蔡伟波教授合作,通过利用光动力治疗造成肿瘤的大面积乏氧来激活生物还原性药物的化疗疗效,实现了对肿瘤生长的高效协同抑制。
大量的研究表明,实体瘤由于肿瘤细胞的快速增殖、血管发育不完全、分布不均一而导致其内部氧气等供应不足,并最终导致肿瘤内乏氧区域的存在。进一步研究发现,肿瘤乏氧区域不但会进一步诱导肿瘤的发展与转移而且严重降低了肿瘤组织对常规化疗、放疗、光动力治疗等治疗手段的响应性,是导致肿瘤治疗失败的一个主要原因。除了尝试通过对肿瘤的乏氧状况进行调节以提高肿瘤治疗的疗效,研究人员近年来还发明了一类生物还原性药物,其在乏氧条件下能转化为有毒性的化疗药物,实现对肿瘤乏氧细胞的选择性杀灭。然而,由于不同肿瘤内乏氧状况的不均一性,这类生物还原性药物在临床试验中无法实现对肿瘤的根治。
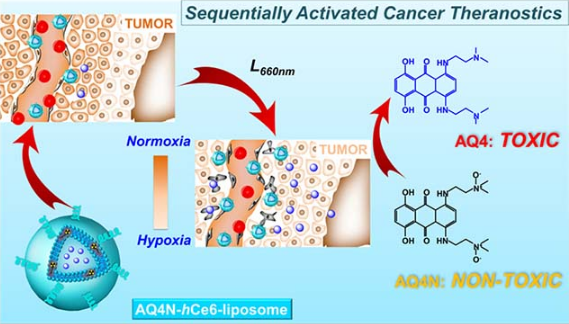
光动力治疗是利用光敏分子在合适波长的激光照射下将分子氧转化成有毒性的单线态氧来实现对肿瘤细胞的杀灭,因而其仅能杀灭肿瘤组织内常氧区域的肿瘤细胞而无法有效杀灭乏氧肿瘤细胞;此外,由于光动力治疗过程中不但会消耗大量的氧气而且会破坏肿瘤血管、阻断肿瘤部位氧气的进一步供应。因而,经光动力治疗后的肿瘤组织会更加乏氧,这将有利于生物还原性药物发挥疗效。基于此,在本研究中,研究人员将疏水光敏分子(h Ce6)和亲水生物还原性药物(AQ4N)共载于脂质体内,得到了体内长循环的 AQ4N-h Ce6-liposome。利用 h Ce6 分子在红光区较强的光学吸收与荧光以及其对放射性同位素(64Cu)的螯合能力,研究人员分别通过荧光成像、光声成像以及正电子发射计算机断层扫描成像等技术来实时追踪 AQ4N-h Ce6-liposome 在小鼠体内的药代动力学行为。通过免疫荧光染色的方法发现小鼠肿瘤经光动力治疗后,其血管结构明显损伤、乏氧状况较未经光动力处理组更为严重。进一步治疗结果显示, AQ4N-h Ce6-liposome 介导的光动力治疗与化疗的联用能够有效地抑制肿瘤的生长,而单独的共动力治疗或 AQ4N 介导的化疗均仅能部分抑制肿瘤的生长。该策略表明通过将光动力治疗与生物还原性药物联用,可以有效克服肿瘤乏氧对光动力治疗疗效的影响而实现对肿瘤的安全、高效杀灭。
这一成果近期发表在《ACS Nano》,文章的第一作者为苏州大学冯良珠博士。
http://pubs.acs.org/doi/abs/10.1021/acsnano.6b07525