科学家揭示肿瘤化疗引起的肠道毒性的分子机制
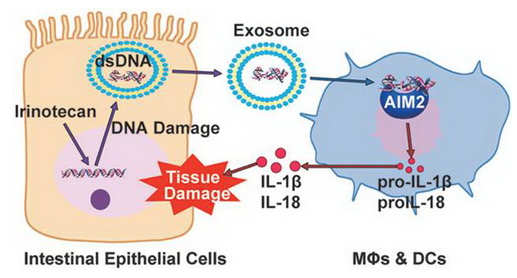
结肠癌化疗诱导 dsDNA 激活 AIM2 炎症小体导致肠道毒性的工作模型
4 月 14 日,国际学术期刊《细胞研究》(Cell Research)在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所孙兵研究组和中国科学院上海药物研究所的题为 Chemotherapy-induced intestinal inflammatory responses are mediated by exosome secretion of double-strand DNA via AIM2 inflammasome activation 的合作研究成果。该研究报道了化疗过程中所导致的肠道毒副作用与化疗药物诱导细胞释放双链 DNA 密切相关,肠道中大量的 dsDNA 激活了宿主免疫系统的 AIM2 炎症小体,进而引发了肠道炎症和损伤的分子机制。耿美玉、孙兵、丁健和黄敏为该论文共同通讯作者。
化疗仍然是目前大多数肿瘤的主要治疗手段,但化疗药物的使用常常伴随着严重的毒副作用。结肠癌是一种高发病率和高致死率的癌症类型,喜树碱类药物(伊立替康)是目前结肠癌治疗的一线化疗药物。该药物因其显著的肿瘤杀伤效果,在临床已经使用二十年以上,但该药物导致的肠道毒副反应严重限制了药物剂量和药物疗效。临床上大约四成的病人会出现腹泻症状,部分病人甚至出现 3 - 4 级腹泻,不仅严重影响病人的生活质量更威胁到病人的生存。伊立替康引起的肠道毒性的分子机制却并不清楚,从而限制了毒性缓解药物的开发使用。越来越多的证据表明,化疗药物的抗肿瘤活性常常与药物引发的抗肿瘤免疫反应相关。因此提高化疗过程中的抗肿瘤免疫应答得到越来越多研究者的青睐,但是过度的不合适的免疫应答对宿主也会造成严重的损害。
此项研究中,博士研究生廉桥石、徐骏、闫闪闪等在四位研究员的共同指导下发现,作为 DNA 损伤药物(拓扑异构酶抑制剂),伊立替康能够触发对药物敏感的细胞释放双链 DNA。在荷瘤鼠和非荷瘤鼠模型中,小肠部位有大量的 dsDNA 释放。同时,临床接受伊立替康化疗的病人外周血中也发现了更高浓度的游离 dsDNA。进一步研究发现,dsDNA 主要借助外泌体 Exosome 释放,而固有免疫细胞能够捕获 Exosome,dsDNA 进而进入胞浆内被 AIM2 识别,诱导炎症小体的激活和下游 IL-1β和 IL-18 炎症因子的成熟,导致肠道炎症反应和腹泻的发生。此项工作为指导化疗药的个性化治疗提供了重要的理论依据和实验证据。
该研究工作得到了中科院、国家科技部和国家自然科学基金委等的经费支持。
https://www.nature.com/cr/journal/vaop/ncurrent/full/cr201754a.html