叹为观止!同期两篇《自然》揭示肿瘤内癌细胞交流和分工机制
热门推荐: 5月20-21北京-生物标志物与液体活检论坛
肿瘤究竟是如何在人体防御系统的严密监视下组建「黑窝点」的?它们真的是盲目疯狂的生长吗?它们是不是也有自己的「智慧」呢?
5 月中旬,来自 MIT 的 Tuomas Tammela 博士团队和来自斯坦福大学医学院的 Jing Shan Lim 博士团队,同时在顶级期刊《自然》杂志上发表两篇重量级研究论文(1,2),揭示了肿瘤内部细胞之间,令人震惊的分工协作机制。更重要的是,透过这些复杂的机制,科学家也为癌症患者找到了更有效的治疗方法。
在我们看来,肿瘤就是一个肿块,我们很难看出肿瘤内部,甚至肿瘤之间存在差异。实际上,在一定程度上,肿瘤非常像一个胚胎。肿瘤细胞的分化命运也是有差异的。这就像胚胎的某些部分会分化成神经系统,有些会分化成心血管系统,有些会分化成呼吸系统。尽管肿瘤细胞的分化没这么彻底和明显。
来自 MIT 的 Tuomas Tammela 博士团队在研究已经进展到晚期的肺腺癌组织时发现,不管是小鼠肺腺癌组织,还是人的肺腺癌组织,里面至少存在两种不同类型的细胞。其中一类肿瘤细胞的 Wnt 信号通路非常活跃;而另一类细胞恰恰是生产 Wnt 蛋白的,同时还生产一种给 Wnt 蛋白加脂肪链尾巴的 porcupine 酶。这暗含了一种可能性,即后一类细胞激活了前一类细胞。
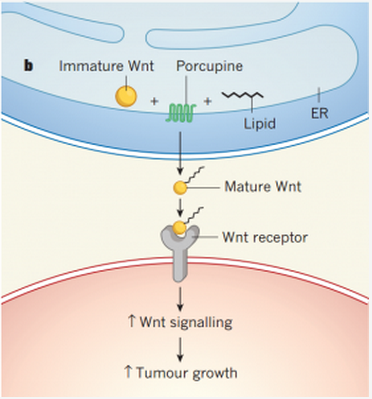
Wnt 信号激活促进 Wnt 反应细胞增殖
Wnt 信号通路对人体胚胎的发育和成人肠道等组织的修复非常关键,它会激活细胞,让细胞进入增殖状态(3)。如果这个信号通路一直处于活跃状态,就意味着这个细胞一直处于分裂状态。而这恰恰是肿瘤组织需要的。
那么肺腺癌组织中的这两种细胞之间是不是存在信号交流呢?当研究人员在实验室中培养癌细胞时,他们发现仅有 2.7% 左右的癌细胞具有增殖能力。当他们把加了脂肪链尾巴的 Wnt 蛋白添加到培养液之后,具备增殖能力的癌细胞比例骤增。如果在培养液中添加的是 porcupine 酶抑制剂或者 Wnt 蛋白抑制剂,那么具备增殖能力的癌细胞比例则会下降。
这就说明,至少在晚期肺腺癌组织中,癌细胞之间是存在不同分工的,有些细胞负责「加油助威、摇旗呐喊」,有些细胞收到信号之后进入野蛮生长状态。那么这种分工状态是何时开始的呢?
研究人员把目光收回到腺瘤时期,这个时期肿瘤呈现出良性状态,还不具备侵袭性。他们发现,只有腺瘤中存在表达 porcupine 酶和 Wnt 蛋白的细胞,这个腺瘤才具备转化为腺癌的能力。这意味着表达 porcupine 酶和 Wnt 蛋白细胞的出现,是腺瘤恶化的关键。只有形成分工,肿瘤组织才能走向更高级的形态。
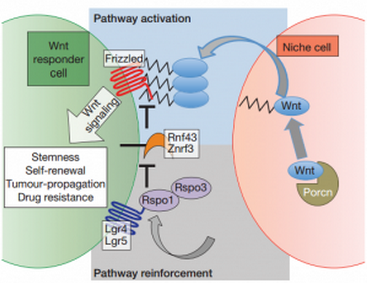
Wnt 信号通路的效应机制
随后,研究人员在胰腺导管腺癌肿瘤组织、结肠腺瘤以及结直肠癌肿瘤组织内检测出了 Wnt 蛋白表达细胞。这表明 Wnt 通路不仅在肺腺癌肿瘤组织内维持一部分细胞的增殖活性,也存在于其他上皮组织肿瘤内。知道了这一点,Tammela 博士团队就开始想办法利用这一点。他们发现,在患有晚期肺腺癌小鼠体内使用 porcupine 抑制剂,可以显著抑制肿瘤的生长和增殖,竟可以使小鼠的生存期延长 50%,而且更重要的是 porcupine 抑制剂显著抑制移植的癌细胞在受体小鼠内的增殖(1)。也就是说,抑制 Wnt 通路不仅抑制癌细胞的增殖,还能抑制初期肿瘤的发展。
Tammela 博士团队在肺腺癌组织中发现的细胞之间的分工已经让人惊叹了,然而 Lim 博士团队在小细胞肺癌的发现简直让人尖叫。那么小细胞肺癌的细胞之间是如何分工合作的呢,它们又是如何联系的呢?
这就涉及到 Notch 通路了。其实科学家对 Notch 通路的研究已经有 100 多年了(5),已有研究表明 Notch 通路既能促进癌症也能抑制癌症(4),但是 Lim 博士在小细胞肺癌内更具体的阐明了这一机制。那么 Notch 是如何影响小细胞肺癌发展的呢? 小细胞肺癌是由神经分泌细胞(NE)发展而来的。但是 Lim 博士最开始却在小细胞肺癌内发现了两种细胞,一种是分泌 Notch 配体的 NE,另一种是分泌 Notch 受体的非神经内分泌细胞(non-NE)。那么 non-NE 是哪儿来的呢?
后来,研究人员发现 NE 细胞中一部分细胞可以同时分泌 Notch 配体和受体。并且激活 Notch 通路后,分泌 Notch 配体的 NE 细胞作用与相邻同时分泌 Notch 配体和受体的 NE 细胞,导致占肿瘤细胞总数约 10%-50% 的同时具备 Notch 受体和配体的 NE 转化为 non-NE,并且这种转化是不可逆的(2)。
这就奇怪了,正常情况下, NE 细胞才是小细胞肺癌的生长以及侵袭的主力。而 NE 细胞转化为 non-NE 后,增殖能力大大减弱。更重要的是,这种转化是由 NE 细胞自发完成的。难道说肿瘤会傻到主动削弱自己?
原来事情并没有这么简单。通过将从小细胞肺癌中提取的 NE 与 non-NE 一起培养发现,两种细胞一起培养增殖能力大大提高,而将二者分开培养,则增殖能力被极大的削弱。而在单独 NE 培养基中加入 non-NE 的提取液,也能显著促进 NE 的增殖。同时 nonNE 提供的生长促进作用不会被 Notch 通路抑制剂阻断。也就是说 NE 的增殖是由 non-NE 中的某种物质产生的。
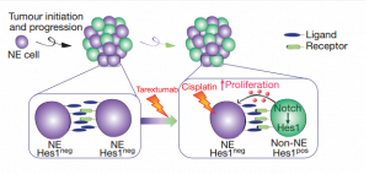
激活 Notch 通路 NE 转化为 non-NE 同时 non-NE 促进 NE 增殖而 Notch 抑制剂(Tarextumab)可以抑制 non-NE 生成,化疗可以抑制 NE 增殖
这表明肿瘤组织并不是在傻傻地主动削弱自己,而是在曲线救国。随后研究人员在 nonNE 以及病人血浆中检测到一种常见的促生物质肝素结合细胞因子(2)。这种物质是胶质细胞分泌的,促进神经细胞生长的物质。也就是说当 NE 上的配体与 non-NE 上的受体结合后,NE 就会促进 non-NE 分泌肝素结合因子用于自己增殖。这就厉害了,机制的肿瘤组织还会给自己的主力准备后勤。
这还不算,更厉害的是,non-NE 还会帮主力挡子弹。研究人员发现在化疗过程中,non-NE 还与小细胞肺癌耐药显著相关。并且在一组小细胞肺癌病人内发现 non-NE 在化疗预后较差病人肿瘤组织数量大大增加,同时,在肿瘤异种移植模型里,用 Notch 抑制剂与化疗联合用药达到了超过二者单独使用的更好的效果。并且 non-NE 数量更少。
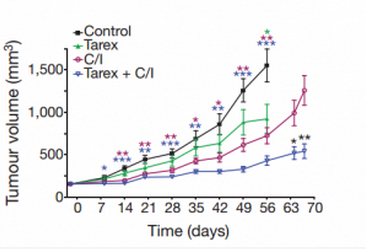
不同治疗方案下肿瘤生长速度(从上到下依次是安慰剂,Notch 抑制剂,化疗,化疗加 Notch 抑制剂)
这就很关键了,机智的肿瘤组织,利用 Notch 通路主动将 NE 转化为 non-NE 原来是为了利用 non-NE 来分泌营养物质促进 NE 细胞的增殖从而更利于自己的生长,而且还能利用 non-NE 做炮灰,从而更利于自己的生存。
搞清楚这些之后,研究人员便进行了临床实验测试 Notch 抑制剂的效果。结果在一期临床中发现 Notch 抑制剂 tarextumab 联合治疗侵袭期小细胞肺癌,可以提高患者总生存期和无进展生存期(NCT01859741)。但是这一现象在二期临床并没有看到。可能是 tarextumab 联合治疗对早期小细胞肺癌患者更有效(数据未公开)。
这就很清楚了,对 Wnt 与 Notch 两个通路的深入探索,让我们对肿瘤的内部机制有了更加清楚的认识。这也为癌症的治疗开辟了新的方向。例如在肺腺瘤时期使用 Wnt 抑制剂可以抑制其恶化。在化疗耐药的小细胞肺癌患者可以联合使用 Notch 抑制剂,而对由 NE 过度繁殖的小细胞肺癌,我们也能通过激活 Notch 通路来抑制其生长。正所谓知己知彼才能百战百胜,对癌症更深入的了解更有利于我们对抗癌症。
参考资料:
1. Tammela T, Sanchez-Rivera F J, Cetinbas N M, et al. A Wnt-producing niche drives proliferative potential and progression in lung adenocarcinoma[J]. Nature, 2017.
2. Lim J S, Ibaseta A, Fischer M M, et al. Intratumoural heterogeneity generated by Notch signalling promotes small-cell lung cancer[J]. Nature, 2017.
3. Clevers, H., Loh, K. M. & Nusse, R. An integral program for tissue renewal and regeneration: Wnt signaling and stem cell control. Science 346, 1248012 (2014)
4. Koch, U. & Radtke, F. Notch and cancer: a double-edged sword. Cell. Mol. Life Sci. 64, 2746–2762 (2007).
5. Ntziachristos, P., Lim, J. S., Sage, J. & Aifantis, I. From fly wings to targeted cancer therapies: a centennial for notch signaling. Cancer Cell 25, 318–334 (2014).