美 FDA 授予 Oncosec 瘤内 DNA 肿瘤免疫疗法 pIL-12 孤儿药资格

OncoSec Medical 是一家专注于开发基于 DNA 的瘤内肿瘤免疫疗法的生物技术公司。近日,该公司宣布美国食品和药物管理局(FDA)已授予 tavokinogene telsaplasmid(pIL-12,一种可表达白细胞介素 -12[IL-12] 的质粒)治疗不可切除性转移性黑色素瘤的孤儿药资格。
IL-12 是一种体内自然产生的蛋白质,具有免疫刺激功能。pIL-12 是 OncoSec 先导候选产品 ImmunoPulse® IL-12 中的活性生物制剂,后者是一种潜在首创(first-in-class)的瘤内抗癌基因疗法,通过瘤内注射及短脉冲电穿孔递送至肿瘤微环境中,产生受控的、局部表达的 IL-12,从而使免疫系统能够靶向并攻击肿瘤细胞,其基于 OncoSec 公司的核心技术平台 ImmunoPulse 开发。
在美国,孤儿药是指用于患病人群不到 20 万人的治疗药物。作为全球最大的医药市场,美国对孤儿药研发的激励强度是最大的,除了 7 年的市场独占期,还有税费减免等其他一系列优惠政策。监管方面,FDA 在今年 2 月还授予了 ImmunoPulse® IL-12 用于既往接受默沙东 PD- 1 免疫疗法 Keytruda(pembrolizumab)或百时美 PD- 1 免疫疗法 Opdivo(nivolumab)治疗后病情进展的转移性黑色素瘤的快速通道地位。
OncoSec 总裁兼首席执行官 Punit Dhillon 表示,此次 FDA 授予 pIL-12 孤儿药资格,是该公司 ImmunoPulse® IL-12 临床开发进程中所达到的一个重要的监管里程碑。目前,该公司正在努力推进该产品的临床开发,以解决既往接受抗 PD- 1 免疫疗法治疗后病情进展的黑色素瘤患者群体中显著未满足的医疗需求。
ImmunoPulse® IL-12 目前处于临床开发,用于转移性黑色素瘤和三阴性乳腺癌(TNBC)的治疗。在 I 期和 II 期临床研究中,其针对多种实体瘤具有良好的安全性,同时表现出明显的抗肿瘤活性和系统性免疫应答。除了 ImmunoPulse® IL-12 之外,OncoSec 也正在开发基于 ImmunoPulse 技术平台的其他免疫靶向制剂。
今年 2 月,OncoSec 公布了 ImmunoPulse® IL-12 联合 Keytruda 治疗不可切除性转移性黑色素瘤的一项单组、开放标签 II 期临床研究数据,该研究入组了 22 例患者,这些患者采用生物标志物进行了评估,被认为对抗 PD- 1 疗法治疗缓解的可能性很低。数据显示,治疗第 24 周时,ImmunoPulse® IL-12 联合 Keytruda 治疗的总缓解率为 43%(9/21),根绝实体瘤疗效评价标准(RECIST)v1.1 评估的最佳总缓解率(BORR)为 48%,完全缓解率为 24%(5/21)、部分缓解率为 19%(4/22),疾病稳定率为 9%(2/21),总的疾病控制率为 52%(11/21)。
这 22 例患者中,有 9 例既往接受免疫检查点抑制剂治疗失败,这一亚组中的总缓解率为 33%(3/99)。通过对血液和组织样品开展的广泛免疫监测表明,ImmunoPulse® IL-12 和 Keytruda 联合用药产生的系统性免疫应答导致肿瘤特异性 CD8+ T 细胞水平升高。这些数据,结合之前公布的临床前和临床数据,为 ImmunoPulse® IL-12 与 PD- 1 阻断疗法联合用药的合理性提供了一个强有力的证据。
今年 5 月,默沙东与 OncoSec 达成了一项临床合作协议,启动多中心 IIb 期注册研究 PISCES,该研究将在既往接受已上市抗 PD- 1 疗法(包括 Keytruda 和 Opdivo)治疗后病情进展的局部晚期或转移性黑色素瘤(阶段 III 或 IV)患者中开展,评估 ImmunoPulse® IL-12 与 Keytruda 联合用药的疗效和安全性。双方的合作将专注于对 PD-1/PD-L1 疗法难治或无缓解的黑色素瘤患者群体中显著未满足的医疗需求。
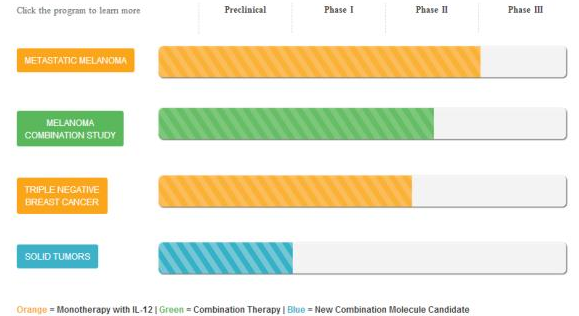
ImmunoPulse® IL-12 的药物递送和作用机制:
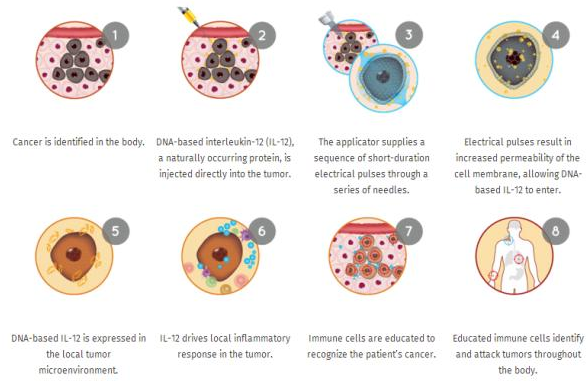
OncoSec 公司管线资产一览表: