Nature 新闻!癌症精准治疗新方法
用个性化的方法创建体外和体内肿瘤模型过程,可以用于帮助确定癌症治疗药物的选择,增加我们对肿瘤治疗反应的理解。
精准癌症治疗通过对肿瘤生物学和前沿技术的最新研究,能够搭配抗癌药物去识别基因改变。关于癌症研究,Pauli 等在线发表了他们利用肿瘤样本的 DNA 测序和对病人的细胞模型测试的论文,揭开了开展这项工作的另一个章节。这项研究使用高通量药物筛选来评估治疗反应模式并扩大选择范围,使癌症治疗走向个性化。
Pauli 和他的同事发起了一项临床研究计划,通过对基因组中蛋白质编码区域的 DNA 进行测序,将每个病人的肿瘤组织和健康组织进行对比,以确定可能是药物靶点引起的肿瘤特异性变化。然而,作者们很快意识到,仅凭 DNA 序列的信息不足以有效指导大多数病例的治疗决策。在接受测试的 501 个癌症患者中,大多数属于癌症晚期,只有大约 10% 的人有基因改变,可以直接匹配使用美国食品和药物管理局 (FDA) 批准的靶向制剂。这一比例包括那些通过非标配药物使用的肿瘤药物,在这种药物中,一种被批准用于治疗某一种肿瘤类型的药物也能够用于治疗另一种肿瘤。
与 Pauli 和他的同事的研究结果形成对照的是,研究人员正在研究的癌症治疗方案,发现大约 40% 的肿瘤使用不那么严格但被广泛接受的标准,这些药剂通常在临床试验中使用。即使如此,对在这两项研究中进行测试的大多数患者来说,由于可用的药物治疗数量有限,DNA 测序结果并没有足够的信息能够用于个性化医疗。
这促使 Pauli 等人尝试另一种方法来识别肿瘤和药物之间潜在的有效匹配。他们使用在体外 3D 细胞培养系统中生长的有机体,这种系统能保持细胞和细胞间的相互作用,以及周围的细胞外基质的相互作用。这些从患者的肿瘤细胞中提取出的物质,能更好地保持组织生物学特性,而不是通用型的单层细胞培养物。有机体为药物敏感筛选提供了一个大规模的平台,为能够早日应用于临床提供了快速地周转时间。
使用这种有机体,Pauli 等构建了近 160 个化合物的文库并进行测试,使他们能够识别有效的药物和药物组合,从而限制癌细胞的生长。他们发现通过体外将器官细胞移植到免疫缺陷的小鼠体内,以产生个性化的治疗模型,即“病人衍生的异种移植”(PDXs),这是癌症治疗前评估的黄金标准(图 1)。Pauli 和他的同事的研究提供了一种基于细胞器有机体的方法,使用高通量进行药物筛选和对来自相同器官的 PDXs 的药物验证。
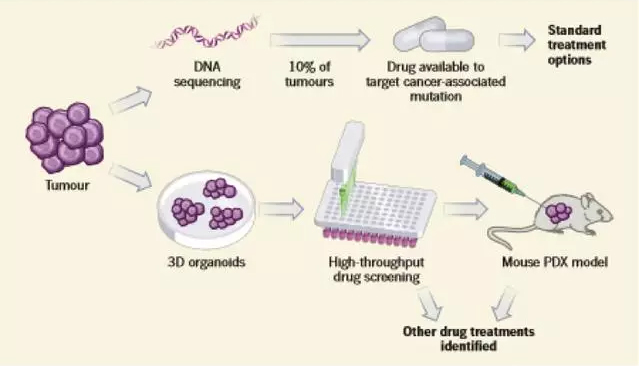
由 145 个样本包括 18 个不同肿瘤类型,研究者从原发性肿瘤的活组织切片或转移到其他位置的癌症细胞组织样本中,进行 56 个器官细胞培养和 19 个 PDX 模型研究。对 4 例患者的肿瘤 DNA 测序、高通量药物剂量反应测试和 PDX 验证结果进行了详细的描述。在体外进行了有效靶向药物的鉴定,在二次药物筛选试验的基础上,选择了最优组合方案进行验证。然而,值得注意的是,个人提出的治疗方案并没有在病人身上进行测试,因此研究人员不能显示他们所选的药物在临床上是主动的。作者们还认识到,在批准的或实验药物的“非标准化”使用仍然是一个巨大的挑战,它限制了基于从这类精准药物平台获得数据的临床测试。

通过对高通量药物敏感性的肿瘤患者样本进行分析,并将其与药物利用的基因组图谱结合在一起,揭示在针对白血病的研究中,对化疗反应不敏感。在非标准化使用药物条件下(在临床试验之外,有生命危险的人可以接触到未经许可的药物),白血病患者通过有效的药物敏感性筛查可以收到预期的药物组合,并且能够承诺一个短期的反应报告。
然而,研究者们也发现了一些证据,即随着白血病在病人体内的发展,肿瘤对经过体外测试过的药剂产生耐药性,并且有可能对其他药物产生潜在的影响,同时 DNA 测序揭示了与疾病进展相关的一系列基因改变。
使用基于肿瘤的药物筛查平台能够精确的预测临床反应,它依赖于培养的细胞物,保留了肿瘤的复杂的分子和生物学特性。虽然癌症 DNA 和转录特点在临床前细胞模型中与患者最初的肿瘤相比是合理的,但在免疫和血管微环境中存在差异。来自抑制免疫系统检查点的药物,和肿瘤细胞与周围细胞(基质细胞)之间的相互作用的药物,不能够被来自于癌症细胞的器官细胞化合物所识别。
此外,有机体通常参与外来物质反应基因和代谢过程基因的高表达,这些基因可能影响癌症细胞的生长和存活。另外,由于在临床前模型中激活药物分子的过程中和在人体中存在差异,因此在有机体内观察到的药物反应可能不能保证病人的反应。此外,化合物的半衰期及其在肿瘤部位的最高浓度在体外和体内实验中都有很大差异。
然而,尽管有这些变化,在选择最佳的药物筛选模型系统时,这些变化是至关重要的,但在 Pauli 等人的研究中,观察到的药物反应模式在有机体和 PDX 系统之间是相对一致的。未来的技术进步可能会提高我们预测临床结果的能力。这些进展可能包括机体实验,包括各种不同的细胞类型,例如基质细胞,模拟体内的微环境,以及更多的具有人类免疫细胞的人性化的免疫缺陷小鼠的 PDX 模型,这将有利于促进免疫疗法的研究。
我们相信来自病人细胞库的真正潜力是研究人员用来生成大型的共享数据库,允许研究复杂肿瘤基因组学和药物敏感性之间的相关性, 以及识别目标药物的组合对于某些肿瘤使用标准的化学疗法能够更好的执行。在选择的单一药物为目标的临床治疗,由于特定基因改变通常是短暂的,而且在大多数情况下,最有效的药物组合不能在 DNA 测序结果和发表的癌症研究的基础上进行选择。
有两种类型的相关性分析可能会被证明是特别有洞察力,一旦有很多病例被提交,而这些合并的“大数据”就可以用于建模。第一种是对不同的行为机制进行药物反应指标的交叉比较。尽管在任何一个肿瘤中存在潜在的基因组和转录变异,但在样本中具有高度相关的敏感性模式的药物群可以锚定联合疗法。第二种方法是将药物敏感性与肿瘤基因组学联系起来。即使只有基因组数据可用,也可以选择与协同效应相结合的药物组合。Pauli 等人所描述的精确治疗方法可能有助于弥合癌症基因组学的理解与个性化治疗设计的发展之间存在的鸿沟。尽管这类方法只在少数研究机构中尝试过,但使用一种有机的高通量筛选平台,已经发现了意想不到的药物靶向。
这种方法允许对在临床试验中评估肿瘤药物敏感性进行鉴定。为了促进这种方法的更广泛的临床应用,必须改进从肿瘤样本中建立器官的成功率,并调查肿瘤细胞的替代来源(如血液样本),以避免依赖于有实体瘤的个体在活体检查时发生转移。随着时间的推移,结合基因组分析,了解药物敏感和耐药个体的进化过程,有机药物筛选技术可能为晚期癌症的最佳真正个性化、适应性和动态治疗铺平道路。