肿瘤免疫治疗中的新型抗原
前言
在近几十年来,肿瘤免疫治疗展现出了巨大的抗癌潜力,其核心在于激活免疫系统以靶向恶性肿瘤,而这一过程取决于肿瘤特异性抗原的存在,此乃基于 T 淋巴细胞肿瘤免疫治疗的关键。
通常情况下,CD4 + 和 CD8+T 淋巴细胞表面的 TCR 分别识别主要组织相容性复合体(MHC)I 和 II 类分子呈递的抗原(Ag)或表位。当 MHC–Ag–TCR 三级复合物作为识别信号与共刺激信号(CD28-CD80/CD86 之间的相互作用)共同形成时,便可触发 T 细胞中的信号转导,进而破坏靶细胞。
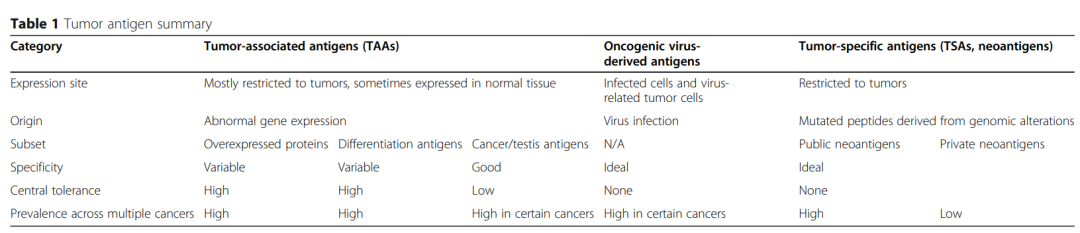
肿瘤抗原有三大主要来源,分别是肿瘤相关抗原(TAAs)、致癌病毒衍生抗原以及肿瘤特异性抗原(TSA)。以下表格对这三种肿瘤抗原的特征进行了总结。
新抗原作为一种源于非同义突变的肿瘤特异性抗原,成为了肿瘤免疫治疗极具吸引力的靶点。得益于下一代测序技术的发展以及机器学习算法的应用,通过描述肿瘤组织内的遗传改变、异常转录后 mRNA 处理以及异常 mRNA 翻译事件来计算预测新抗原已变为可能。因此,以新抗原为基础的疗法,如癌症疫苗,已在临床试验中得到广泛测试,且已证实具有良好的安全性和有效性,为肿瘤免疫治疗开创了一个新纪元。
新抗原的鉴定
与 TAA 不同,TSA / 新抗原是从肿瘤基因组的遗传改变中获取的突变肽,仅在肿瘤细胞中特异性表达,在正常组织中并不存在,故而具有极高的肿瘤特异性,同时降低了非靶向毒性。基于新抗原的个性化免疫疗法能够激发针对肿瘤细胞的强大抗肿瘤免疫反应。
新抗原的鉴定依赖于对肿瘤和正常组织的 DNA 和 RNA 样本进行高通量测序数据。通过运用生物信息学方法分析全外显子组测序(WES)和 mRNA 转录组测序(RNA Seq)数据,可以确定可能导致新抗原表位的 DNA 和 RNA 水平突变。
一般来说,非同义单核苷酸变异(SNV)和 DNA 插入或缺失是新抗原预测的主要来源。然而,仅仅关注这两种类型的突变往往会低估肿瘤潜在的新抗原,新抗原还可以来源于许多其他类型,包括:
(1)基因融合事件;
(2)剪接位点产生突变(SCM);
(3)mRNA 内含子保留;
(4)内源性逆转录转座。
值得注意的是,来自其他类型突变(如基因融合和 SCM)的新抗原通常比 SNV 衍生的新抗原更具免疫原性。
此外,与新抗原免疫原性相关的重要数据还包括:
(1)患者的突变肽与 HLA 等位基因之间的亲和力;
(2)肽 HLA 复合物的结合稳定性;
(3)宿主基因的表达。
除了来自 WES 和 RNA-Seq 数据的特征外,描述突变肽与 T 细胞受体之间识别潜力的其他特征也可纳入新抗原预测系统。
合成长肽(SLP)疫苗
基于新抗原的肿瘤治疗主要涵盖合成长肽(SLP)疫苗、核酸(DNA/mRNA)疫苗、基于树突状细胞(DC)的疫苗、基于新抗原特异性 TCR-T 细胞的治疗以及与公共新抗原相关的双特异性抗体。基于这些个性化新抗原疗法的临床试验已在全球晚期癌症患者中展开。
当前,基于合成肽的新抗原疫苗已在多个临床试验中得到应用,一些临床试验已经显示出多肽肿瘤新抗原疫苗的抗肿瘤效力。NeoVax 是一种针对黑色素瘤患者的个体化新抗原肽疫苗,在一项 1 期临床试验(NCT01970358)中,选取经病理证实为 IIIB/C 和 IVM1a/b 期高危黑色素瘤患者,在术后中位数 18 周后接受 NeoVax 治疗。以 20 种新抗原为靶点的个体化肽疫苗由聚 ICLC 配制而成,聚 ICLC 是一种合成的双链 RNA(dsRNA)模拟物,能够刺激 TLR3 和 MDA5。通过刺激 MDA5,Poly-ICLC 可有效诱导 IFN-I 和 IL-15,还能促进 T 细胞扩增并增强 T 细胞浸润,使其成为肽癌疫苗的有效佐剂。
2021 年,研究公布了 8 名参与本试验的黑色素瘤患者的随访结果,平均随访时间为 55 个月。结果表明,所有 8 名患者均存活,6 名患者没有活动性疾病的迹象。对患者外周血中 T 细胞的测试显示,接种 NeoVax 疫苗后,黑色素瘤患者的新抗原特异性 T 细胞反应可持续数年,并且新抗原特异性 T 细胞呈现出记忆表型。
此外,研究还发现,NeoVax 能够诱导 T 细胞反应的表位扩散,这也意味着肿瘤特异性细胞毒性范围的拓宽。然而,本研究中的三名患者在接种后 26、40 和 40 个月复发,另外两名患者在接种后不久复发,但在接受抗 PD-1 抑制剂 pembrolizumab 治疗后,他们很快获得完全缓解。
Ib 期临床试验(NCT02897765)研究了个性化新抗原疫苗 NEO-PV-01 与 PD-1 阻断剂联合治疗晚期黑色素瘤、非小细胞肺癌或膀胱癌患者的疗效。在本试验中,新抗原肽与佐剂聚 ICLC 混合后皮下注射,Nivolumab 在疫苗接种期间持续使用。结果显示,黑色素瘤、非小细胞肺癌和膀胱癌患者的总体响应率分别为 59%、39% 和 27%,中位无进展生存期(PFS)分别为 23.5 个月、8.5 个月和 5.8 个月;1 年总生存率为 96%、83% 和 67%,这些数据均不低于 PD-1 抗体单一疗法的历史数据。接种疫苗后也观察到表位扩散,并与更长的 PFS 相关。
核酸(DNA/mRNA)疫苗
基于 DNA/mRNA 的新抗原疫苗通过与基于肽的疫苗类似的步骤发挥作用,只是在 DC 中多了额外的翻译和 / 或转录步骤。与肽相比,核酸制剂有助于抗原的持续有效表达和免疫刺激。重要的是,核酸制剂从细胞内产生抗原肽,避免了昂贵且复杂的蛋白质纯化过程,并为蛋白质配备了天然的翻译后修饰。核酸疫苗在效力、缩短设计和制造时间以及生产可扩展性和可靠性方面具有优势。目前,新抗原靶向的 DNA/mRNA 癌症疫苗也已在各种临床试验中进行了测试。
在一项 1b 期临床试验(NCT03289962)中,在先前接受过多次治疗的晚期实体瘤患者中测试了一种基于 RNA 脂质体新抗原的个性化疫苗 RO7198457,该疫苗编码多达 20 种新抗原。总共有 29 名患者接受了 RO7198457 单药治疗,132 名患者接受了 RO7198457 联合抗 PD-L1 抗体 atezolizumab 的治疗。根据至少接受过一次肿瘤评估的患者数据,该试验显示单药治疗的客观缓解率(ORR)为 4%(1/26)和 40% 的疾病稳定率(SD,9/26),联合治疗的 ORR 为 8%(9/108),SD 为 49%(53/108)。在两组的大多数患者中,RO7198457 诱导了新抗原特异性 T 细胞反应。
在另一项 1 期临床试验(NCT03313778)中,测试了另一种基于 RNA 的新抗原疫苗 mRNA-4157。在 79 名接受 mRNA-4157 治疗的患者中,16 名接受单药治疗,63 名与 pembrolizumab 联合应用。mRNA-4157 安全且耐受性良好,联合给药组观察到 3 例完全缓解(CR)和 8 例部分缓解(PR)。特别是在 10 名头颈部鳞状细胞癌(HNSCC)患者中,ORR 为 50%,中位无进展生存期(mPFS)为 9.8 个月,而 pembrolizumab 单药治疗的 ORR 仅为 14.6%,mPFS 为 2 个月。
DC 疫苗和新抗原特异性 TCR-T
最近,一项 I 期临床试验(NCT02956551)研究了个性化新抗原自体 DC 疫苗(Neo DCVac)治疗 12 例重度转移性肺癌的安全性和有效性。结果显示,该疫苗总体安全性良好,客观缓解率(ORR)为 25%,疾病控制率(DCR)为 75%,中位无进展生存期(mPFS)为 5.5 个月,中位总生存期(mOS)为 7.9 个月。当与免疫检查点抑制剂(ICI)治疗联合使用时,Neo-DCVac 显示出协同治疗效果。这些结果表明,Neo DCVac 可诱导特异性 T 细胞免疫,该试验首次证明了基于新抗原的 DC 疫苗对癌症患者的疗效。
基于 TCR 的工程化 T 细胞治疗是新抗原应用的另一种选择。与 DC 疫苗试验相比,目前尚无新抗原特异性 TCR-T 细胞治疗的临床试验结果,仅发表了病例报告。
这些病例包括一名接受 KRAS-G12D 靶向肿瘤浸润淋巴细胞(TIL)治疗的转移性结直肠癌患者和一名接受 TIL 治疗的化疗难治性 HR 阳性转移性乳腺癌患者,TIL 分别针对 SLC3A2、KIAA0368、CADPS2 和 CTSB 中分布的四种突变。这两例治疗均取得临床疗效,同时接受 IL-2 和免疫检查点抑制剂(ICI)联合治疗的乳腺癌患者在超过 22 个月的时间内表现出完全持久的消退,而仅接受 KRAS-G12D 靶向 TIL 治疗的转移性结直肠癌患者在治疗后 9 个月后疾病进展。
基于新抗原的 T 细胞疗法的最大挑战之一是识别和分离这些突变特异性 TIL 和 TCR。另外,以新抗原为基础的 DC 和 TCR-T 疗法,要注意包括细胞因子释放综合征(CRS)等可能致命的副作用。
基于公共新抗原的癌症疫苗
与纯粹个性化的新抗原相比,公共或共享的新抗原来源于癌基因的驱动突变或基因组中的其他热点突变。它们的特点是在具有特定癌症亚型的患者子集中呈现出免疫原性表位。因此,公共新抗原的发现依赖于从相当大的患者库中分析个体化新抗原。公共新抗原的一个主要优点是,它们可以快速应用于癌症患者,特别是晚期癌症患者和治疗窗口较窄的患者。此外,带有公共新抗原的癌症疫苗将降低治疗成本。
公共新抗原的一个例子是 KRAS 上 G12D 的突变,该突变在胰腺癌、结肠腺癌、非小细胞肺和结直肠癌中常见。类似地,TP53 是一种众所周知的肿瘤抑制基因,在大量癌症中广泛突变,具有广泛的热点突变,并为多种癌症所共有。
目前,多数针对公共新抗原的临床试验仍在进行中,而一些早期试验报告了良好的结果。在一项开放标签、单臂 I 期临床试验(NCT01250470)中,测试了 survivin 肽(BIRC5)在 9 名复发恶性胶质瘤患者中的安全性和有效性,survivin 肽长 15 个氨基酸,包含不同的 8 到 10 个氨基酸的免疫原性表位,具有相同的 C57M 突变。结果显示一些患者得到了部分缓解或病情稳定至少 6 个月。
在另一项具有类似设计的试验(NCT02261714)中,KRAS 突变肽 TG01(包含已知的七个致癌突变)被用作疫苗,与粒细胞 - 巨噬细胞集落刺激因子(GM-CSF)联用,用于 32 例 I 期或 II 期胰腺癌患者,这些患者接受了手术切除(R0 或 R1),其中 93.75% 携带可检测到的 KRAS 突变。结果显示,低剂量组的安全性较好。两种剂量都产生了强烈的细胞免疫反应,受试者 2 年和 3 年的存活率分别约为 72% 和 37%。总之,公共新抗原疫苗已证明其作为癌症治疗靶点的巨大价值。
与公共新抗原相关的双特异性抗体
双特异性抗体是一类可同时针对两种抗原的抗体,它连接效应器细胞和靶细胞,使效应器细胞充分发挥肿瘤的杀伤作用。最近,报道了一项针对 TP53 基因热点突变 R175H 新抗原的双特异性抗体的临床前研究,靶向 p53R175H/HLA-a*02:01 的单链抗体与抗 CD3e 单链抗体(UCHT1)连接,这种 T 细胞导向的新抗原双特异性抗体在体外和体内显示出强大的抗肿瘤免疫活性。
小结
近年来,基于个性化或公共新抗原的抗肿瘤治疗在新抗原的识别、预测或筛选以及治疗选择方面取得了巨大进展。以 mRNA 为载体的新抗原疫苗和以公众新抗原为靶点的新抗原疫苗显示出了更好的临床特性和成药性,并引起了人们对下一代精确肿瘤免疫治疗发展的极大兴趣。
然而,基于新抗原的治疗仍然存在一些挑战,新抗原疫苗的几个方面尚待优化,以实现更好的临床反应。首先,识别和制造新抗原所需的时间相对较长,至少需要 6 - 8 周,鉴于目前可用的新抗原预测算法的精度较低,需要大量的努力以利用机器学习平台来提高新抗原预测精度。其次,需要在临床试验中测试和评估最佳新抗原配方和相应的修饰、所使用的新抗原递送系统、路线以及安全有效的给药剂量。此外,新抗原疫苗与 TAAs 和其他免疫调节剂疗法相结合已显示出良好的协同治疗效果,因此,在未来的研究中应进一步评估使用新抗原疫苗与放疗、化疗或ICIs和TME免疫调节剂的联合应用。相信新抗原疫苗作为一种崭新的并极富前景的技术,解决好这些问题,其必定会在未来的肿瘤免疫治疗领域中占据一席之地。
在近几十年来,肿瘤免疫治疗展现出了巨大的抗癌潜力,其核心在于激活免疫系统以靶向恶性肿瘤,而这一过程取决于肿瘤特异性抗原的存在,此乃基于 T 淋巴细胞肿瘤免疫治疗的关键。
通常情况下,CD4 + 和 CD8+T 淋巴细胞表面的 TCR 分别识别主要组织相容性复合体(MHC)I 和 II 类分子呈递的抗原(Ag)或表位。当 MHC–Ag–TCR 三级复合物作为识别信号与共刺激信号(CD28-CD80/CD86 之间的相互作用)共同形成时,便可触发 T 细胞中的信号转导,进而破坏靶细胞。
肿瘤抗原有三大主要来源,分别是肿瘤相关抗原(TAAs)、致癌病毒衍生抗原以及肿瘤特异性抗原(TSA)。以下表格对这三种肿瘤抗原的特征进行了总结。
新抗原作为一种源于非同义突变的肿瘤特异性抗原,成为了肿瘤免疫治疗极具吸引力的靶点。得益于下一代测序技术的发展以及机器学习算法的应用,通过描述肿瘤组织内的遗传改变、异常转录后 mRNA 处理以及异常 mRNA 翻译事件来计算预测新抗原已变为可能。因此,以新抗原为基础的疗法,如癌症疫苗,已在临床试验中得到广泛测试,且已证实具有良好的安全性和有效性,为肿瘤免疫治疗开创了一个新纪元。
新抗原的鉴定
与 TAA 不同,TSA / 新抗原是从肿瘤基因组的遗传改变中获取的突变肽,仅在肿瘤细胞中特异性表达,在正常组织中并不存在,故而具有极高的肿瘤特异性,同时降低了非靶向毒性。基于新抗原的个性化免疫疗法能够激发针对肿瘤细胞的强大抗肿瘤免疫反应。
新抗原的鉴定依赖于对肿瘤和正常组织的 DNA 和 RNA 样本进行高通量测序数据。通过运用生物信息学方法分析全外显子组测序(WES)和 mRNA 转录组测序(RNA Seq)数据,可以确定可能导致新抗原表位的 DNA 和 RNA 水平突变。
一般来说,非同义单核苷酸变异(SNV)和 DNA 插入或缺失是新抗原预测的主要来源。然而,仅仅关注这两种类型的突变往往会低估肿瘤潜在的新抗原,新抗原还可以来源于许多其他类型,包括:
(1)基因融合事件;
(2)剪接位点产生突变(SCM);
(3)mRNA 内含子保留;
(4)内源性逆转录转座。
值得注意的是,来自其他类型突变(如基因融合和 SCM)的新抗原通常比 SNV 衍生的新抗原更具免疫原性。
此外,与新抗原免疫原性相关的重要数据还包括:
(1)患者的突变肽与 HLA 等位基因之间的亲和力;
(2)肽 HLA 复合物的结合稳定性;
(3)宿主基因的表达。
除了来自 WES 和 RNA-Seq 数据的特征外,描述突变肽与 T 细胞受体之间识别潜力的其他特征也可纳入新抗原预测系统。
合成长肽(SLP)疫苗
基于新抗原的肿瘤治疗主要涵盖合成长肽(SLP)疫苗、核酸(DNA/mRNA)疫苗、基于树突状细胞(DC)的疫苗、基于新抗原特异性 TCR-T 细胞的治疗以及与公共新抗原相关的双特异性抗体。基于这些个性化新抗原疗法的临床试验已在全球晚期癌症患者中展开。
当前,基于合成肽的新抗原疫苗已在多个临床试验中得到应用,一些临床试验已经显示出多肽肿瘤新抗原疫苗的抗肿瘤效力。NeoVax 是一种针对黑色素瘤患者的个体化新抗原肽疫苗,在一项 1 期临床试验(NCT01970358)中,选取经病理证实为 IIIB/C 和 IVM1a/b 期高危黑色素瘤患者,在术后中位数 18 周后接受 NeoVax 治疗。以 20 种新抗原为靶点的个体化肽疫苗由聚 ICLC 配制而成,聚 ICLC 是一种合成的双链 RNA(dsRNA)模拟物,能够刺激 TLR3 和 MDA5。通过刺激 MDA5,Poly-ICLC 可有效诱导 IFN-I 和 IL-15,还能促进 T 细胞扩增并增强 T 细胞浸润,使其成为肽癌疫苗的有效佐剂。
2021 年,研究公布了 8 名参与本试验的黑色素瘤患者的随访结果,平均随访时间为 55 个月。结果表明,所有 8 名患者均存活,6 名患者没有活动性疾病的迹象。对患者外周血中 T 细胞的测试显示,接种 NeoVax 疫苗后,黑色素瘤患者的新抗原特异性 T 细胞反应可持续数年,并且新抗原特异性 T 细胞呈现出记忆表型。
此外,研究还发现,NeoVax 能够诱导 T 细胞反应的表位扩散,这也意味着肿瘤特异性细胞毒性范围的拓宽。然而,本研究中的三名患者在接种后 26、40 和 40 个月复发,另外两名患者在接种后不久复发,但在接受抗 PD-1 抑制剂 pembrolizumab 治疗后,他们很快获得完全缓解。
Ib 期临床试验(NCT02897765)研究了个性化新抗原疫苗 NEO-PV-01 与 PD-1 阻断剂联合治疗晚期黑色素瘤、非小细胞肺癌或膀胱癌患者的疗效。在本试验中,新抗原肽与佐剂聚 ICLC 混合后皮下注射,Nivolumab 在疫苗接种期间持续使用。结果显示,黑色素瘤、非小细胞肺癌和膀胱癌患者的总体响应率分别为 59%、39% 和 27%,中位无进展生存期(PFS)分别为 23.5 个月、8.5 个月和 5.8 个月;1 年总生存率为 96%、83% 和 67%,这些数据均不低于 PD-1 抗体单一疗法的历史数据。接种疫苗后也观察到表位扩散,并与更长的 PFS 相关。
核酸(DNA/mRNA)疫苗
基于 DNA/mRNA 的新抗原疫苗通过与基于肽的疫苗类似的步骤发挥作用,只是在 DC 中多了额外的翻译和 / 或转录步骤。与肽相比,核酸制剂有助于抗原的持续有效表达和免疫刺激。重要的是,核酸制剂从细胞内产生抗原肽,避免了昂贵且复杂的蛋白质纯化过程,并为蛋白质配备了天然的翻译后修饰。核酸疫苗在效力、缩短设计和制造时间以及生产可扩展性和可靠性方面具有优势。目前,新抗原靶向的 DNA/mRNA 癌症疫苗也已在各种临床试验中进行了测试。
在一项 1b 期临床试验(NCT03289962)中,在先前接受过多次治疗的晚期实体瘤患者中测试了一种基于 RNA 脂质体新抗原的个性化疫苗 RO7198457,该疫苗编码多达 20 种新抗原。总共有 29 名患者接受了 RO7198457 单药治疗,132 名患者接受了 RO7198457 联合抗 PD-L1 抗体 atezolizumab 的治疗。根据至少接受过一次肿瘤评估的患者数据,该试验显示单药治疗的客观缓解率(ORR)为 4%(1/26)和 40% 的疾病稳定率(SD,9/26),联合治疗的 ORR 为 8%(9/108),SD 为 49%(53/108)。在两组的大多数患者中,RO7198457 诱导了新抗原特异性 T 细胞反应。
在另一项 1 期临床试验(NCT03313778)中,测试了另一种基于 RNA 的新抗原疫苗 mRNA-4157。在 79 名接受 mRNA-4157 治疗的患者中,16 名接受单药治疗,63 名与 pembrolizumab 联合应用。mRNA-4157 安全且耐受性良好,联合给药组观察到 3 例完全缓解(CR)和 8 例部分缓解(PR)。特别是在 10 名头颈部鳞状细胞癌(HNSCC)患者中,ORR 为 50%,中位无进展生存期(mPFS)为 9.8 个月,而 pembrolizumab 单药治疗的 ORR 仅为 14.6%,mPFS 为 2 个月。
DC 疫苗和新抗原特异性 TCR-T
最近,一项 I 期临床试验(NCT02956551)研究了个性化新抗原自体 DC 疫苗(Neo DCVac)治疗 12 例重度转移性肺癌的安全性和有效性。结果显示,该疫苗总体安全性良好,客观缓解率(ORR)为 25%,疾病控制率(DCR)为 75%,中位无进展生存期(mPFS)为 5.5 个月,中位总生存期(mOS)为 7.9 个月。当与免疫检查点抑制剂(ICI)治疗联合使用时,Neo-DCVac 显示出协同治疗效果。这些结果表明,Neo DCVac 可诱导特异性 T 细胞免疫,该试验首次证明了基于新抗原的 DC 疫苗对癌症患者的疗效。
基于 TCR 的工程化 T 细胞治疗是新抗原应用的另一种选择。与 DC 疫苗试验相比,目前尚无新抗原特异性 TCR-T 细胞治疗的临床试验结果,仅发表了病例报告。
这些病例包括一名接受 KRAS-G12D 靶向肿瘤浸润淋巴细胞(TIL)治疗的转移性结直肠癌患者和一名接受 TIL 治疗的化疗难治性 HR 阳性转移性乳腺癌患者,TIL 分别针对 SLC3A2、KIAA0368、CADPS2 和 CTSB 中分布的四种突变。这两例治疗均取得临床疗效,同时接受 IL-2 和免疫检查点抑制剂(ICI)联合治疗的乳腺癌患者在超过 22 个月的时间内表现出完全持久的消退,而仅接受 KRAS-G12D 靶向 TIL 治疗的转移性结直肠癌患者在治疗后 9 个月后疾病进展。
基于新抗原的 T 细胞疗法的最大挑战之一是识别和分离这些突变特异性 TIL 和 TCR。另外,以新抗原为基础的 DC 和 TCR-T 疗法,要注意包括细胞因子释放综合征(CRS)等可能致命的副作用。
基于公共新抗原的癌症疫苗
与纯粹个性化的新抗原相比,公共或共享的新抗原来源于癌基因的驱动突变或基因组中的其他热点突变。它们的特点是在具有特定癌症亚型的患者子集中呈现出免疫原性表位。因此,公共新抗原的发现依赖于从相当大的患者库中分析个体化新抗原。公共新抗原的一个主要优点是,它们可以快速应用于癌症患者,特别是晚期癌症患者和治疗窗口较窄的患者。此外,带有公共新抗原的癌症疫苗将降低治疗成本。
公共新抗原的一个例子是 KRAS 上 G12D 的突变,该突变在胰腺癌、结肠腺癌、非小细胞肺和结直肠癌中常见。类似地,TP53 是一种众所周知的肿瘤抑制基因,在大量癌症中广泛突变,具有广泛的热点突变,并为多种癌症所共有。
目前,多数针对公共新抗原的临床试验仍在进行中,而一些早期试验报告了良好的结果。在一项开放标签、单臂 I 期临床试验(NCT01250470)中,测试了 survivin 肽(BIRC5)在 9 名复发恶性胶质瘤患者中的安全性和有效性,survivin 肽长 15 个氨基酸,包含不同的 8 到 10 个氨基酸的免疫原性表位,具有相同的 C57M 突变。结果显示一些患者得到了部分缓解或病情稳定至少 6 个月。
在另一项具有类似设计的试验(NCT02261714)中,KRAS 突变肽 TG01(包含已知的七个致癌突变)被用作疫苗,与粒细胞 - 巨噬细胞集落刺激因子(GM-CSF)联用,用于 32 例 I 期或 II 期胰腺癌患者,这些患者接受了手术切除(R0 或 R1),其中 93.75% 携带可检测到的 KRAS 突变。结果显示,低剂量组的安全性较好。两种剂量都产生了强烈的细胞免疫反应,受试者 2 年和 3 年的存活率分别约为 72% 和 37%。总之,公共新抗原疫苗已证明其作为癌症治疗靶点的巨大价值。
与公共新抗原相关的双特异性抗体
双特异性抗体是一类可同时针对两种抗原的抗体,它连接效应器细胞和靶细胞,使效应器细胞充分发挥肿瘤的杀伤作用。最近,报道了一项针对 TP53 基因热点突变 R175H 新抗原的双特异性抗体的临床前研究,靶向 p53R175H/HLA-a*02:01 的单链抗体与抗 CD3e 单链抗体(UCHT1)连接,这种 T 细胞导向的新抗原双特异性抗体在体外和体内显示出强大的抗肿瘤免疫活性。
小结
近年来,基于个性化或公共新抗原的抗肿瘤治疗在新抗原的识别、预测或筛选以及治疗选择方面取得了巨大进展。以 mRNA 为载体的新抗原疫苗和以公众新抗原为靶点的新抗原疫苗显示出了更好的临床特性和成药性,并引起了人们对下一代精确肿瘤免疫治疗发展的极大兴趣。
然而,基于新抗原的治疗仍然存在一些挑战,新抗原疫苗的几个方面尚待优化,以实现更好的临床反应。首先,识别和制造新抗原所需的时间相对较长,至少需要 6 - 8 周,鉴于目前可用的新抗原预测算法的精度较低,需要大量的努力以利用机器学习平台来提高新抗原预测精度。其次,需要在临床试验中测试和评估最佳新抗原配方和相应的修饰、所使用的新抗原递送系统、路线以及安全有效的给药剂量。此外,新抗原疫苗与 TAAs 和其他免疫调节剂疗法相结合已显示出良好的协同治疗效果,因此,在未来的研究中应进一步评估使用新抗原疫苗与放疗、化疗或ICIs和TME免疫调节剂的联合应用。相信新抗原疫苗作为一种崭新的并极富前景的技术,解决好这些问题,其必定会在未来的肿瘤免疫治疗领域中占据一席之地。