干货速递 | 免疫治疗新契机 —— 肿瘤新生抗原鉴定
肿瘤新生抗原是由肿瘤细胞特异性表达的一类抗原,其源自肿瘤细胞内发生突变的基因。经过细胞内复杂的表达和加工过程后,肿瘤新生抗原与主要组织相容性复合物(major histocompatibility complex, MHC)分子结合,并呈现在细胞表面,进而被 T 细胞识别。这一过程会激活机体的免疫系统,引发一系列免疫应答反应,最终达到清除肿瘤细胞的目的。
肿瘤新抗原的发现与优化,对于推动下一代癌症免疫治疗至关重要。与肿瘤相关抗原不同,肿瘤相关抗原虽在癌细胞中过度表达,但也存在于正常或具有免疫原性的组织中。而肿瘤新抗原具有肿瘤特异性,被适应性免疫系统视作外来表位。
正因如此,肿瘤新抗原能够激活不受免疫耐受影响的高亲和力细胞毒性 T 淋巴细胞(CTL),同时避免对非肿瘤组织造成 “脱靶” 损伤。这些特性使得肿瘤新生抗原成为肿瘤免疫治疗的理想靶点,具备广泛的治疗前景和临床应用价值。
肿瘤新生抗原的临床研究进展
根据美国临床试验数据库显示,目前涉及新生抗原疫苗的临床研究共有 129 项。在新生抗原疫苗的研发领域,欧美企业处于领先地位,代表性公司有 BioNTech、Neon Therapeutics、Gristone Oncology 等。中国企业也在积极跟进,代表性公司包括华大吉诺因、裕策生物、纽安津生物、新合生物、立康生命科技等。新生抗原疗法正在覆盖更为广泛的癌症类型,尤其是实体瘤,其中黑色素瘤、乳腺癌及肺癌是排名前三的适应症。此外,新生抗原疫苗与免疫检查点抑制剂(ICIs)或化疗等联合使用的疗法更为普遍。总体而言,全球新生抗原疗法行业仍处于实验研究阶段,目前尚无产品上市。
新生抗原在众多临床试验中取得了良好的治疗效果,代表性成果不断涌现。据报道,在临床研究(NCT03185429)中,一名 66 岁的转移性胃癌患者在接受个性化的载有新生抗原的单核细胞衍生的树突状细胞疫苗(Neo-MoDC)后,产生了较强的 T 细胞反应。联合免疫检查点抑制剂 nivolumab(纳武单抗)后,引发了更强的免疫反应,使得所有肿瘤完全消退(图 2)。截至 2021 年 10 月,该患者已持续完全缓解超过 25 个月。此外,Neon 公司开发的 NEO-PV-01 是一种 “量身定制” 的个体化新抗原疫苗。在早期临床试验(NCT02897765)中,该疫苗延长了黑色素瘤、非小细胞肺癌(NSCLC)和膀胱癌患者的无进展生存期。这一结果彰显了癌症疫苗这一创新免疫治疗模式的巨大潜力。2021 年 1 月,国际顶级癌症期刊《Nature medicine》发布的一项 1 期临床研究(NCT01970358)显示,8 例晚期黑色素瘤且手术后有高复发风险的患者,在接受个性化的 NeoVax 疫苗治疗后,由疫苗引发的控制肿瘤生长的免疫反应已持续超过 4 年(56 个月),目前这 8 例患者的病情均无进展。
在国内,新生抗原相关研究也发展迅速。2020 年 1 月,华大吉诺因宣布其 “靶向新生抗原自体免疫 T 细胞注射液 Neo-T” 的临床试验申请获得了国家药监局 CDE 的临床试验默示许可。今年,纽安津、新合和立康三家公司的新生抗原疫苗的新药临床试验申请先后获得 CDE 受理,其疫苗形式分别为多肽疫苗、mRNA 疫苗和 mRNA-DC 疫苗。
虽然新生抗原疫苗疗法作为癌症免疫治疗的新方法,能使患者的免疫细胞特异性地精准攻击肿瘤细胞,但目前已进行和提交的临床试验大多处于 1 期状态,一些制药公司正在尝试开展更多的 2 期试验。随着更多科学和临床数据揭示基于新生抗原疫苗疗法在多种癌症类型中的疗效,以及对新生抗原生物学特性的更好理解,我们相信基于新生抗原的疗法是癌症免疫疗法中极具前景的领域,将开启肿瘤个性化免疫治疗的新篇章。
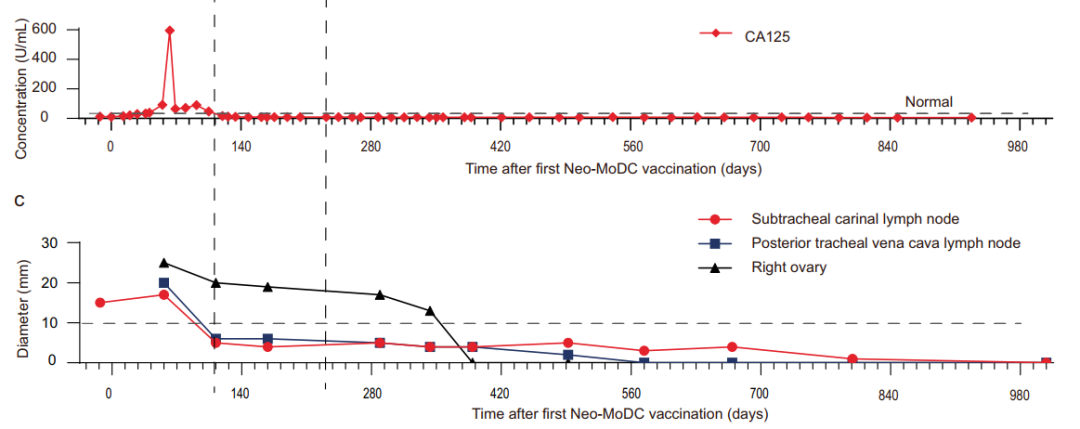
接受Neo-MoDC疫苗和nivolumab联合治疗后肿瘤肿瘤标志物CA125和肿瘤病灶大小变化
肿瘤新生抗原的鉴定
1988 年,De Plaen 等人利用 cDNA 文库筛选,在小鼠肿瘤模型中发现了第一个能被 T 细胞识别的新生抗原。该文章表明,正常基因和肿瘤基因之间仅有一个核苷酸的差异,这个突变导致产生了一个氨基酸的变化。肿瘤体细胞突变的来源极为广泛,我们必须对这些突变序列进行预测,筛选出最能特异性引起机体免疫应答反应的候选新生抗原,这是个性化肿瘤免疫治疗应用中的关键环节。
2012 年,NGS 技术首次被报道应用于小鼠肿瘤模型中新生抗原的鉴定,并迅速得到广泛应用。目前,基于全外显子组测序(WES)技术和不断优化的生物信息学筛选算法,科学家们已经发现了众多新生抗原。在该技术中,经典方案是先获取患者的肿瘤组织和正常组织,通过高通量测序技术初步识别肿瘤体细胞中的突变序列,再借助经过训练的 AI 算法预测潜在的肿瘤新生抗原。在预测过程中,需要考虑多方面因素,包括 HLA 分型、蛋白酶体剪切、TCR 结合力、MHC 亲和力、肿瘤新抗原来源等。此外,还包括用于评估 T 细胞反应的相关因素,如 T 细胞识别、TCR 分析等。
虽然目前 AI 算法预测的准确度在大量科学家和越来越多的验证性数据集的持续训练下已大大提升,但如何从潜在的不相关新生抗原中准确且灵敏地识别出真正具有靶向作用的新生抗原仍是一大挑战。通常,科学家们仍需结合体外实验来验证潜在的新生抗原是否具有活性,是否真正能引发患者的抗肿瘤反应。因此,进一步提高算法的准确性至关重要,其中数据类型、质量和数量都会极大地影响算法的精度。通过不断积累数据库,尤其是经过验证的肿瘤新抗原数据,有望进一步提高此类新生抗原预测技术的准确性。
近年来,基于质谱法检测新生抗原的技术在许多文献中得到了应用。质谱法可以直接鉴定真实呈现在肿瘤细胞表面的新生抗原肽段,其鉴定原理是将肿瘤细胞表面的抗原肽从 HLA 分子上洗脱下来,采用质谱对其直接进行测序。
目前的质谱技术可以从细胞系和患者临床样本中识别数千个 MHC 呈递的多肽序列。质谱分析法用于新生抗原筛选的一个优势是它极大地缩小了新生抗原的候选范围,并且是一种不带偏向性的方法,可极大提高新生抗原的筛选准确性。质谱法直接测定到的具有免疫原性的新生抗原序列可能与 HLA 没有那么高的亲和力,因此基因测序方式可能无法发现这类有真实功能的新生抗原。此外,它还具有发现非典型肿瘤特异性 HLA 多肽的能力。研究表明,非典型肿瘤特异性 HLA 多肽更有可能作为新生抗原靶点。而 NGS 基于蛋白编码区,主要关注 SNVs 等典型肿瘤抗原,不能充分评估其他非典型肿瘤抗原。但质谱检测法能够定位不能从 NGS 中预测得到的非典型多肽,如蛋白酶体剪切的肽段、由非编码区翻译的肽段及翻译后修饰 PTMs 的肽段等。其中,PTMs 对 MHC 抗原加工和呈递有影响,而 PTMs 不能通过基因组 / 转录组测序预测,因此肿瘤新生抗原的 PTMs 鉴定也依赖于质谱技术。
最后,如果对预测的靶标肿瘤抗原在样本内的绝对表达量值感兴趣,可以通过合成同位素肽段结合质谱定量技术实现,该方法具有极高的灵敏度和准确性。
展望
免疫疗法已成为癌症治疗的关键方式之一。免疫检查点抑制剂(ICI)和其他形式的免疫治疗使许多患者的生存率显著提高,但仅有一小部分患者能从免疫疗法中受益。因此,理解抗肿瘤免疫反应的分子基础,如肿瘤如何被 T 细胞识别,成为目前免疫治疗的重点方向。与检查点抑制剂、CAR-T 等较为成熟的细胞疗法相比,新抗原疫苗在癌症免疫治疗领域仍处于快速发展期,并且面临诸多挑战,如寻求更有效的新生抗原鉴定方法、改进新抗原预测的筛选方法以提高准确性、开发不同肿瘤疫苗的递送技术等。
然而,近年来,随着越来越多相关基础研究和临床试验的开展,基于肿瘤新生抗原的免疫疗法在临床试验中已显示出非常良好的治疗效果。我们有理由相信,基于肿瘤新生抗原的疗法是癌症免疫疗法中极具前景的领域,并将最终惠及肿瘤患者。
参考文献:
[1] Yarchoan M, Johnson B, Lutz E, et al. Targeting neoantigens to augment antitumour immunity. Nat Rev Cancer 2017, 17, 209–222.
[2] Zhang Z, Lu M, Qin Y, et al. Neoantigen: A New Breakthrough in Tumor Immunotherapy. Front Immunol. 2021,12:672356.
[3] Guo Z, et al. Durable complete response to neoantigen-loaded dendritic-cell vaccine following anti-PD-1 therapy in metastatic gastric cancer[J]. npj Precision Oncology, 2022, 6(1).
[4] Ott PA, et al. A Phase Ib Trial of Personalized neo antigen Therapy Plus Anti-PD-1 in Patients with Advanced Melanoma, Non-small Cell Lung Cancer, or Bladder Cancer. Cell. 2020, 15;183(2):347-362.e24.
[5] Hu Z, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma. Nat Med. 2021, 27(3):515-525.
[6] de Plaen E, Lurquin C, van Pel A, et al. Immunogenic (tum-) variants of mouse tumor P815: cloning of the gene of tum- antigen P91A and identification of the tum- mutation[J]. Proc Natl Acad Sci USA, 1988, 85(7): 2274-2278.
[7] Matsushita H, Vesely MD, Koboldt DC, Rickert CG, Uppaluri R, Magrini VJ, et al. Cancer exome analysis reveals a T-cell-dependent mechanism of cancer immunoediting. Nature. 2012, 482:400–4.
[8] Garcia-Garijo A, Fajardo CA and Gros A. Determinants for Neoantigen Identification. Front.Immunol. 2019, 10:1392.
[9] Purcell AW, Ramarathinam SH, Ternette N. Mass Spectrometry–Based Identification of MHC-Bound Peptides for Immunopeptidomics. Nat. Protoc. 2019, 14, 1687–1707.
[10] Yadav M, Jhunjhunwala S, Phung QT, et al. Predicting Immunogenic Tumour Mutations by Combining Mass Spectrometry and Exome Sequencing. Nature 2014, 515, 572–576.
[11] Newey A, et al. Immunopeptidomics of Colorectal Cancer Organoids Reveals a Sparse HLA Class I Neoantigen Landscape and No Increase in Neoantigens with Interferon or MEK-Inhibitor Treatment. J. Immunother Cancer 2019, 7, 309.
[12] Ebrahimi-Nik H, et al. Mass Spectrometry–Driven Exploration Reveals Nuances of Neoepitope-Driven Tumor Rejection. JCI Insight 2019, 4.
[13] Murphy JP, et al. MHC-I Ligand Discovery Using Targeted Database Searches of Mass Spectrometry Data: Implications for T-Cell Immunotherapies. J. Proteome Res. 2017, 16, 1806–1816.
[14] Chen R, et al. Chemical Derivatization Strategy for Extending the Identification of MHC Class I Immunopeptides. Anal. Chem. 2018, 90, 11409–11416.
[15] Laumont CM, et al. Noncoding Regions Are the Main Source of Targetable Tumor-Specific Antigens. Sci. Trans. Med. 2018, 10:470.
[16] Emily HC, et al. Targeting a neoantigen derived from a common TP53 mutation. Science 2021, 371.6533:eabc8697.