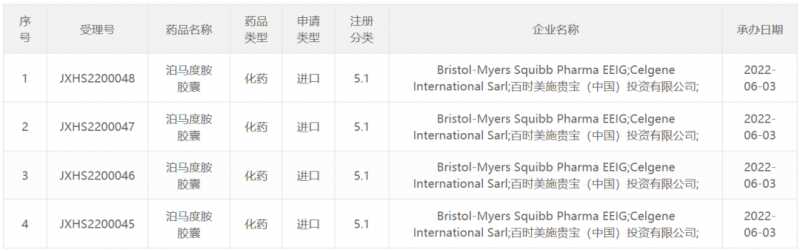
中国国家药监局药品审评中心(CDE)官网公示,百时美施贵宝公司(BMS)已递交5.1类新药泊马度胺胶囊的上市申请,并获得受理。
泊马度胺 pomalidomide(Pomalyst)泊马度胺 pomalidomide (Pomalyst®)说明书 【药品介绍】 Pomalyst(pomalidomide)胶囊获美国FDA批准用于治疗多发性骨髓瘤新药。
由美国塞尔基因公司研发,并于2013 年2 月首次经美国FDA获准上市。
【中文名称】泊马度胺胶囊 【商用名称】Pomalyst 【化学名称】3-氨基-N-(2,6-二氧-3-哌啶基)苯邻二甲酰亚胺 【分子式】C13H11N3O4 【分子量】273.25
Pomalidomide,一种沙利度胺类似物,是一种有抗肿瘤活性。免疫调节剂。在体外细胞学试验,pomalidomide 抑制造血肿瘤细胞增殖和诱导凋亡。此外,pomalidomide 抑制来那度胺-耐药多发性骨髓瘤细胞株的增殖和在来那度胺-敏感和来那度胺-耐药细胞株与地塞米松协同诱导肿瘤细胞凋亡。Pomalidomide增强T细胞-和天然杀伤(NK)细胞介导的免疫和抑制单核细胞促炎性细胞因子的生成(如,TNF-α和IL-6)。在小鼠肿瘤模型和和体外脐带模型中Pomalidomide 显示抗血管生成活性。
POMALYST是一种沙利度胺类似物适用为有多发性骨髓瘤患者,曾接受至少两种既往治疗包括来那度胺[lenalidomide]和硼替佐米[bortezomib],对治疗没有应答(未能奏效)和在最后一次治疗后60天内进展(复发和难治性)的患者。
重复28天疗程在第1-21天每天口服4mg直至疾病进展。请参考【地塞米松剂量】。
胶囊:1mg,2mg,3mg和4mg。
(1)血液学毒性:中性粒细胞减少是最常报道3/4级不良事件。监视患者血液学毒性,尤其是中性粒细胞减少。 (2)肝:肝功能衰竭包括死亡;监测肝功能检查每月一次。 (3)过敏反应:血管性水肿和严重皮肤病反应的报道。对于血管性水肿中止POMALYST和严重皮肤病反应。 (4)肿瘤溶解综合征(TLS):TLS在风险监测患者(即,那些具有高肿瘤负荷),并采取适当的预防措施。
最常见不良反应(≥30%)包括疲乏和虚弱,中性粒细胞减少,贫血,便秘,恶心,腹泻,呼吸困难,上呼吸道感染,背痛和发热。
强CYP1A2抑制剂:避免使用强CYP1A2抑制剂,除非必要的医疗。
(1)哺乳母亲:终止药物或哺乳考虑药物对母亲的重要性。 (2)有血清肌酐 >3.0mg/dL患者中避免POMALYST。
STRATUS研究方法:第1-21天,给予泊马度胺4 mg;第1,8,15和22天,给予低剂量地塞米松40mg(年龄>75岁的患者,20 mg),治疗至患者疾病进展或不可耐受的毒性反应。主要研究终点是安全性,次要终点包括总响应率(ORR)、响应持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。
该研究共纳入682名RRMM患者,中位年龄为66岁,距离确诊的中位时间为5.3年。先前接受的中位治疗数为5。大多数患者同时对来那度胺和硼替佐米难治(80.2%)。中位随访为16.8个月;中位治疗持续时间为4.9个月。最常见的3/4级治疗突发性不良反应为血液学毒性(中性粒细胞减少[ 49.7% ],贫血[ 33% ],和血小板减少症[ 24.1% ])。最常见的3/4级非血液学毒性事件为肺炎(10.9%)和疲乏(5.9%)。3/4级静脉血栓栓塞和周围神经病变比较少见(各占1.6%)。ORR为32.6%,中位DOR为7.4个月。中位PFS和OS分别为4.6个月和11.9个月。
截止目前,该研究是规模最大的泊马度胺和低剂量地塞米松治疗RRMM的评估试验,进一步证实了该方案可带来显著意义的临床获益,并且通常易耐受。
|
|---|
概述
中国国家药监局药品审评中心(CDE)官网公示,百时美施贵宝公司(BMS)已递交5.1类新药泊马度胺胶囊的上市申请,并获得受理。