《自然》:癌细胞寻找肝脏的技能真是绝了!中山大学宋尔卫团队发现,中性粒细胞死后留下的DNA骨架,竟然为癌细胞指明了肝脏的方向
巨噬细胞、成纤维细胞甚至是血小板,统统都被奇点糕的小本子记到过“帮凶”那一栏。就连《工作细胞》里无比可靠的宠妻狂魔“白哥”中性粒细胞,现实中也可能会被策反,攻击奋战的T细胞,简直是背刺无处不在啊。
为什么明明写的是免疫细胞,奇点糕脑海里却总想到一本小说……
(图片来源:NIH)
而今天《自然》上发表的一篇最新论文,又揭开了中性粒细胞,死了都能为癌作伥的一面:中山大学宋尔卫院士团队发现,中性粒细胞的一种特殊死亡方式——胞外诱捕网(NET),竟然会成为癌症向肝、肺等器官转移的关键机制!
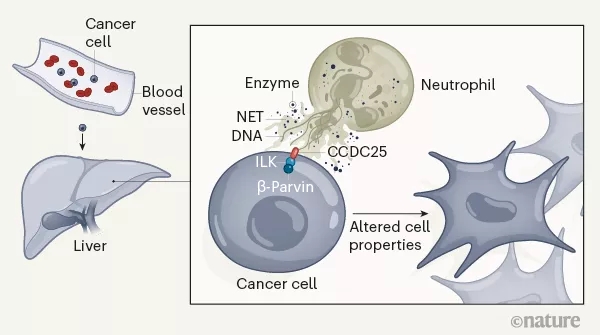
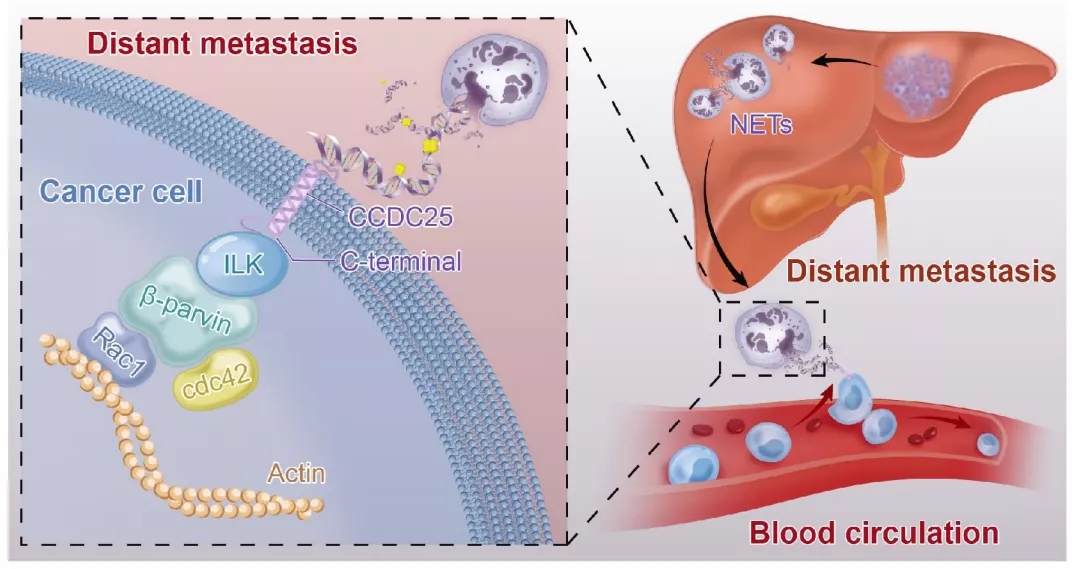
具体来说,血液中来自NET的DNA成分(NET-DNA),会被癌细胞表面一个名为CCDC25的受体识别,两者结合就相当于给癌细胞释放了导航指令,把它们吸引到肝脏,形成远处转移灶。
而临床上的乳腺癌和结肠癌患者数据也显示,肝脏周围NET较多,与癌症更容易肝转移有关,患者癌细胞的CCDC25受体表达水平高,也与预后较差直接挂钩。因此阻断中性粒细胞的这条促转移机制,可能是未来治疗肝转移癌的关键[1]。
宋尔卫院士表示,肝脏的中性粒细胞容易投敌,和肝脏生成补体的功能有关
(图片来源:《自然》)
作为人体免疫系统抗击感染的第一道防线,胞外诱捕网这道机制,本来应该是中性粒细胞杀伤病菌的利器。
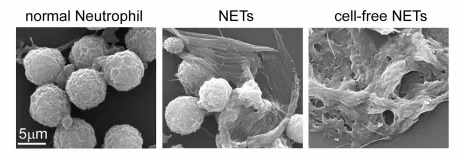
在受到病原体、细胞因子等刺激时,中性粒细胞就会发生一种特殊的死亡,把细胞内部的许多物质吐出来,形成一张以DNA为骨架,镶嵌着各种蛋白的网,也就是NET,让这张网来捕获和消灭病原体。
电镜下正常的中性粒细胞(左)、NET(中)和游离的NET(右)
听上去是不是很大义凛然,而且还有点儿酷呢?但近年来的几项研究却显示,NET这张网却可能捕获在血液中循环的癌细胞,甚至是通过唤醒休眠癌细胞的方式,促进癌症的远处转移,这可就一点儿都不酷了[2-3]。
不过此前的研究大多是在小鼠模型上进行的,小鼠癌症和人体癌症的区别比较大,同时研究也没有进一步深究NET促进癌症转移的具体机制,还停留在“偶然捕获”这一步。搞清这些问题,就是本次宋尔卫院士团队研究的目标。
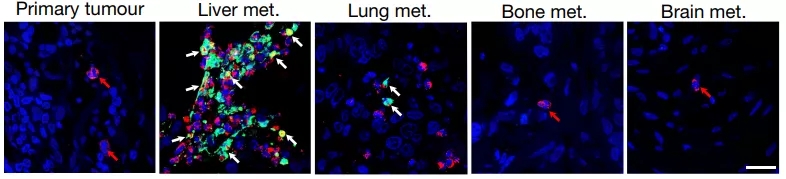
研究团队首先对544名乳腺癌患者的原发灶和转移灶进行了免疫荧光染色,以确定不同癌灶的NET分布情况。染色很快就显示,NET在乳腺癌原发灶周围非常少见,但在各种转移灶附近却有大量分布,其中肝转移灶附近数量最多。
看看肝转移灶周围这五光十色的样子
如果采用定量手段,以检测髓过氧化酶-DNA复合物的方式判断患者体内的NET水平,那么可以实现对患者肝转移风险的预测,预测的曲线下面积(AUC)达到0.863。将来这种准确度不错的预测方法,完全可以通过简单的验血来实现。
接下来,研究团队把战场转移到了小鼠模型上,分析肿瘤肝转移与NET的因果关系。实验显示,NET确实出现在肝转移灶之前,而且形成NET的中性粒细胞也是肝脏的“本地居民”,并非千里迢迢从肿瘤部位赶来的。
如果把中性粒细胞形成NET的一种关键酶——肽基精氨酸脱氨酶4(PAD4)基因敲除,让NET无法生成,那么乳腺癌和结肠癌转移到肝脏的情况就会显著减少。这说明没有NET,癌细胞想成功转移到肝脏绝非易事。
进一步的实验也显示,NET在整个过程中发挥的作用,绝不止“偶然捕获”这么简单。就拿NET-DNA来说,它可以直接作为趋化因子,增强癌细胞的迁移能力和黏着力,相当于变成了吸引癌细胞的一个重要信号。
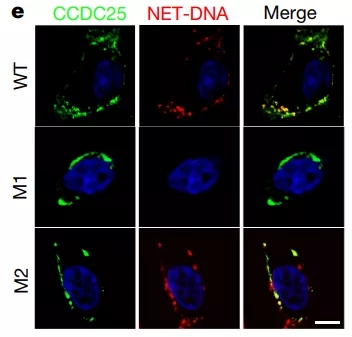
癌细胞虽然是狡猾多端,也不至于强到能跟NET玩心灵感应,肯定是有受体能识别这个吸引信号。研究团队发现,这个受体就是前面提到的CCDC25,此前它在癌细胞中的功能并不为人知,这次算是破案了。
CCDC25和NET-DNA的分布几乎完全重合,说你俩不是一对谁信啊
研究团队从本院收集的肠癌和乳腺癌患者预后数据,以及数据库中肺癌等癌种的数据显示,CCDC25在癌细胞表面的表达水平,确实与患者预后有明显关联,表达水平高与患者长期生存率下降有关。
接下来,研究团队敲除掉CCDC25这个感应器,就发现癌细胞向肝脏转移的能力受到了明显抑制。此外由肺部的细菌脂多糖(LPS)诱发炎症,让癌细胞经由NET向肺转移的路也被堵上了,这算是一石二鸟啦。
最后,研究团队分析了一下CCDC25和NET-DNA结合后,癌细胞发生的变化,发现这种结合会激活ILK-β-parvin细胞骨架信号通路,增强癌细胞的运动能力,从而促进转移的发生。
这个骨架信号通路也是比较新鲜的发现
到这里,本次研究的内容才告一段落,是不是信息量够大,也足够有意义呢?因此《自然》同期配发的社论中,两位英国弗朗西斯-克里克研究所的科学家,也对这项研究给予了高度评价。
社论指出,这项研究的发现,不仅可以用于预测患者的肝转移风险,还明确了CCDC25与NET-DNA结合的具体位点,这样就可以定向研发药物,来限制癌症的肝转移。至于这种机制是否出现在其他部位的转移中,还需要进一步研究[4]。
而在接受媒体采访时,宋尔卫院士表示,本次研究还可能用到抗击新冠肺炎等感染性疾病中。因为CCDC25这个感应器,在很多免疫细胞表面也是存在的。
假如NET在感染性疾病中,也会像吸引癌细胞一样,通过NET-DNA和CCDC25的结合,把其它免疫细胞吸引过来,就可能导致致命的炎症因子风暴,不过这还有待后续研究证实[5]。
反正不管是癌症要命的肝转移,还是新冠病毒的夺命炎症因子风暴,都赶紧退散啊!希望这项研究能早一天转化到临床,对这帮敌人,千万别手下留情。
参考资料:
1.Yang L, Liu Q, Zhang X, et al. DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25 [J]. Nature, 2020.
2.Cools-Lartigue J, Spicer J, McDonald B, et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis[J]. The Journal of Clinical Investigation, 2013, 123(8): 3446-3458.
3.Albrengues J, Shields M A, Ng D, et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice[J]. Science, 2018, 361(6409): eaao4227.
4.https://www.nature.com/articles/d41586-020-01672-3
5.http://epaper.southcn.com/nfdaily/html/2020-06/12/content_7887847.htm