PNAS:他汀让癌细胞不能大口吃肉!科学家发现,他汀可以抑制癌细胞的大胞饮,让癌细胞不能摄取蛋白质,最终被活活饿死
“神药”他汀的作用可不少,除了老本行降血脂之外,还可能具有预防AD和抗癌的作用。研究显示,与癌症关系最为紧密的基因p53突变,会让甲羟戊酸途径失控,而这也正是他汀的作用靶点。
不过他汀抑制住了甲羟戊酸途径之后,又是怎么让癌细胞死亡的?最近一项研究显示,那些癌细胞可能是活活饿死的。
不久前,约翰霍普金斯大学的Zhihua Jiao和Peter Devreotes等研究发现,两种他汀类药物——匹伐他汀和氟伐他汀,通过抑制甲羟戊酸途径,导致细胞中香叶基香叶酰二磷酸(GGPP)的耗尽,抑制了癌细胞的大胞饮,让癌细胞无法获得足够的营养而饿死。这一研究发表在PNAS上[1]。
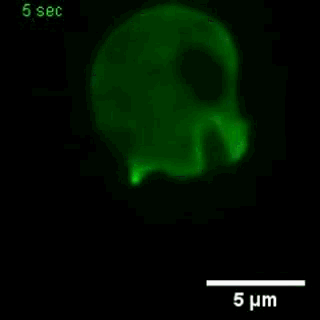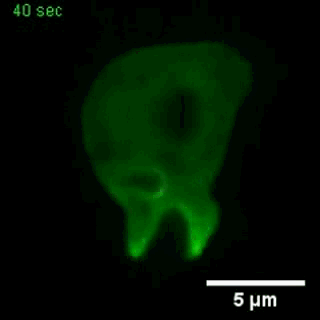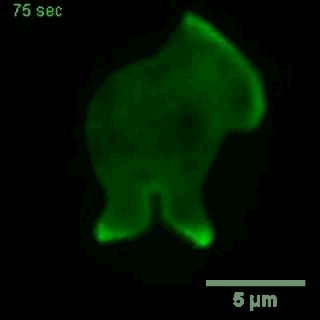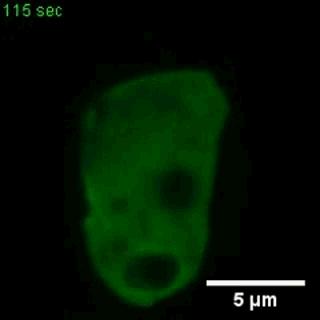
大胞饮
(来自gfycat.com)
癌细胞的生存和迁移,听起来像是八竿子打不着的两件事,不过在基因层面上,这两件事的关系好像还挺紧密。一些癌细胞中经常突变的原癌基因和抑癌基因,比如Rap、Ras、PTEN等等,就对癌细胞的生存和迁移都有影响[2]。
在一种模式生物盘基网柄菌中的研究也显示,这些基因控制着细胞骨架网络的活动,伸出伪足、大胞饮等活动,都要受到这些基因的影响[3]。
大胞饮,这不正是癌细胞增强适应性的技能之一吗?比如普遍携带KRAS突变的胰腺癌,大胞饮就十分活跃,可以不断的从细胞外摄取蛋白质,获得谷氨酰胺等重要的营养物质,成为癌中之王。那针对这些影响大胞饮的基因,会不会能找出一些新的抗癌药?
(来自wikimedia.org)
研究人员敲除了盘基网柄菌中的抑癌基因PTEN,对FDA已经批准的药物进行了高通量筛选。在接受测试的2560种药物中,有7种对PTEN缺失的盘基网柄菌的生长或细胞极性产生了显著的影响。其中效果最明显的是两种他汀类药物——氟伐他汀和匹伐他汀。
在敲除了PTEN的乳腺癌细胞中,氟伐他汀和匹伐他汀也让癌细胞从最初的纺锤形逐渐变形,在48~72小时内凋亡,而对PTEN基因正常的癌细胞没有影响。
他汀是一类广泛使用的降脂药,通过抑制HMG-CoA还原酶,减少甲羟戊酸和胆固醇的合成来降低血脂[4],而补充甲羟戊酸也能阻止他汀对癌细胞的毒性。进一步研究显示,他汀减少了细胞中香叶基香叶酰二磷酸(GGPP)水平,阻碍了癌细胞里的香叶基香叶酰修饰,进而造成癌细胞的死亡。
缺少GGPP合成酶(GGPPS),无法合成GGPP的细胞,在GGPP水平低的培养液中,细胞运动明显减少,最终停止,细胞表面形成的各种凸起也小了很多。而大胞饮的第一步就是要细胞伸出伪足,包裹住被吞的东西,细胞凸起小了,大胞饮是不是也少了?
低GGPP水平下,细胞表面凸起变小
果然,研究人员发现,PTEN缺陷的乳腺癌细胞,通过大胞饮摄取的蛋白本身就比野生型的少了46%,而匹伐他汀又进一步让PTEN缺陷细胞的大胞饮摄入减少了41%,严重影响了癌细胞获取营养物质。对野生型细胞的大胞饮,他汀则没有作用。
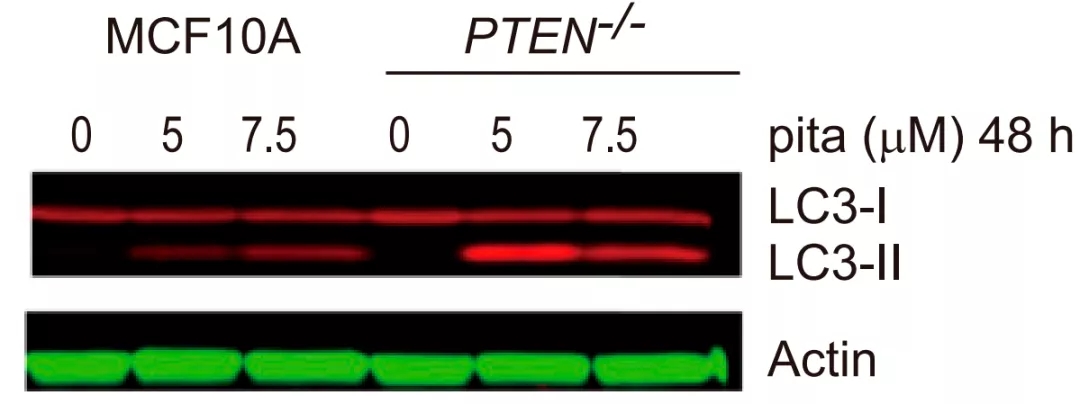
为了应对大胞饮的减少和营养物质的缺乏,他汀作用下,PTEN缺陷型细胞只好通过自噬来获取一些营养,自噬标志物LC3-II水平明显增加。但这也不过是苟延残喘,最终还是被活活“饿死”。
匹伐他汀使PTEN缺陷细胞中自噬标志物LC3-II水平升高
此外,对于KRAS的G12V突变引起的大胞饮增加,他汀也有很好的抑制效果。本身,引入了KRAS突变的乳腺癌细胞,大胞饮水平比野生型细胞高了87%。而在1μM和2μM的匹伐他汀作用下,KRAS突变细胞的大胞饮暴降64%和84%,而野生型细胞的大胞饮只分别减少了11%和17%。
目前,这一研究离临床还有一定距离。在后续的研究中,论文通讯作者Devreotes计划进一步探究他汀和GGPPS抑制剂对人体的影响。或许它们能成为一类新的抗癌药。
参考文献:
1. Jiao Z, Cai H, Long Y, et al. Statin-induced GGPP depletion blocks macropinocytosis and starves cells with oncogenic defects[J]. Proceedings of the National Academy of Sciences, 2020, 117(8): 4158-4168.
2. Yamada K M, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis[J]. Journal of cell science, 2001, 114(13): 2375-2382.
3. Miao Y, Bhattacharya S, Edwards M, et al. Altering the threshold of an excitable signal transduction network changes cell migratory modes[J]. Nature cell biology, 2017, 19(4): 329-340.
4. Larsson O. HMG-CoA reductase inhibitors: role in normal and malignant cells[J]. Critical reviews in oncology/hematology, 1996, 22(3): 197-212.