《细胞》子刊:癌王又一秘笈被破解!研究发现,肿瘤新抗原反倒会促进胰腺癌进展,增强树突状细胞功能可破解
胰腺癌可以说是当之无愧的癌王,转移快,复发率高,生存期短,就连免疫治疗这个大杀器都对它无可奈何。
至于胰腺癌为何能抵抗免疫治疗,曾经有人认为这要归因于胰腺癌突变负荷低,缺乏肿瘤新抗原,免疫细胞认不出来它。不过最近一项研究显示,其中可能另有隐情,胰腺癌的强大超乎想象。
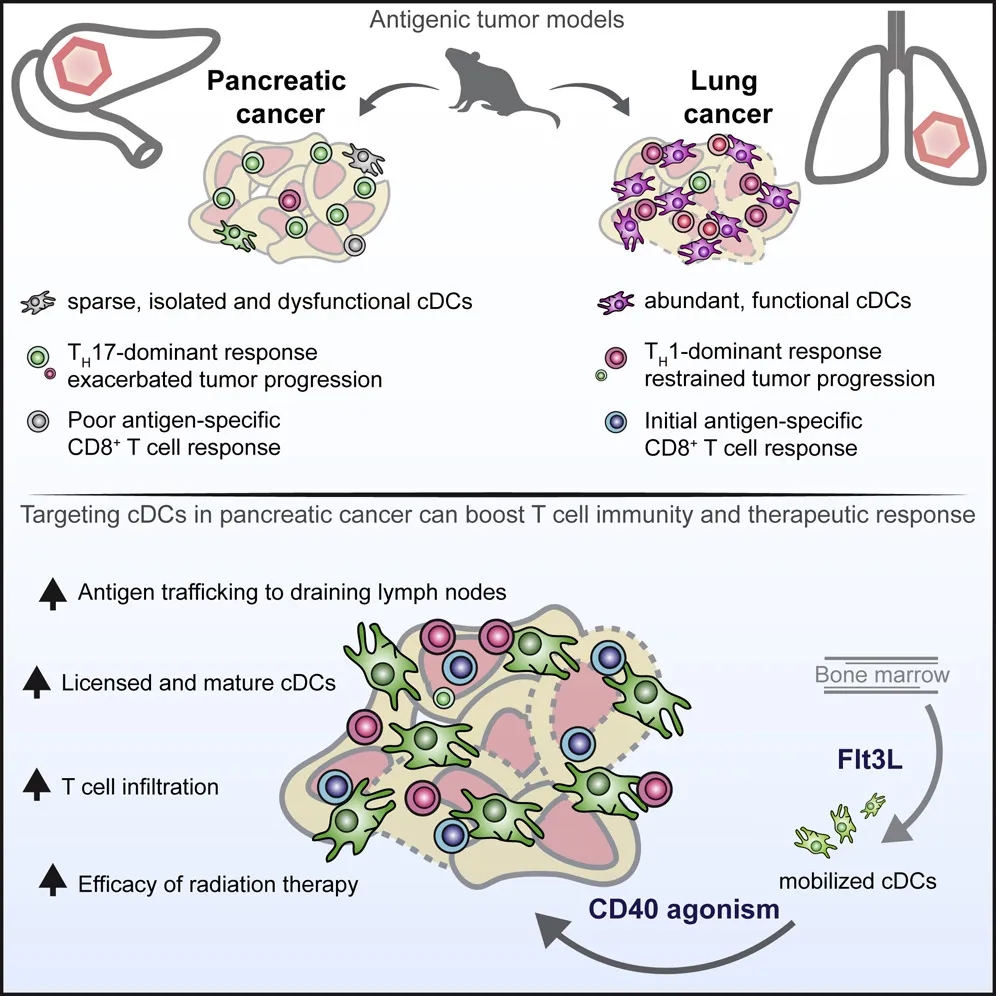
近日,华盛顿大学的Samarth Hegde和David DeNardo等研究发现,在一般肿瘤中会促进抗癌免疫,抑制肿瘤进展的肿瘤新抗原,到了胰腺癌中却会让肿瘤进展得更快。究其原因在于胰腺癌中呈递抗原的树突状细胞数量稀少,功能缺陷,不能引起抗癌免疫,反倒让Th17细胞分泌IL-17改造肿瘤微环境,便于肿瘤生长转移。这一研究发表在Cancer Cell上[1]。
肿瘤来自人体组织,很多地方都跟人体组织都长得很像。免疫系统要从一大堆正常的人体组织中把癌细胞揪出来,靠的主要就是肿瘤突变过程中产生的肿瘤新抗原。而能带来更多新抗原的肿瘤突变负荷,也是目前预测免疫治疗效果的最佳指标之一。
不过在胰腺癌中,有些患者的肿瘤里确实存在不少新抗原,也有可被激活的T细胞,但就是对免疫治疗没有反应[2,3]。为何胰腺癌能成为免疫治疗钉子户?研究人员们展开了研究。
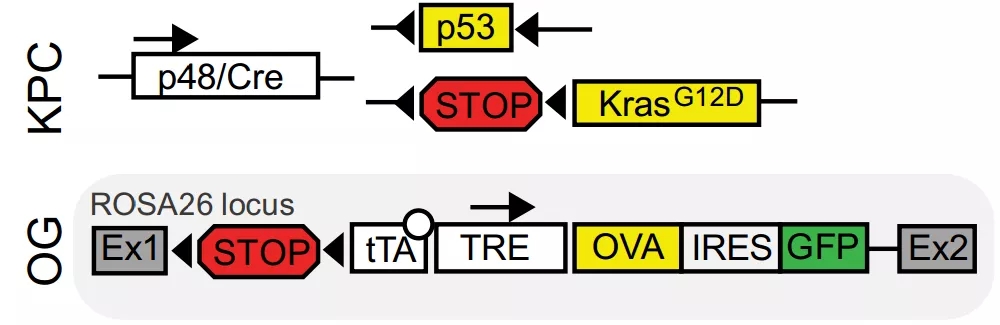
由于通常所用的异种移植小鼠模型,缺乏肿瘤基质,所处的炎症环境也跟自发形成的胰腺癌有明显不同,研究人员这次选用了自发性胰腺癌的KPC小鼠。这种小鼠选择性敲除胰腺中的KRAS和TP53基因,在两三个月内几乎都会发展出胰腺癌。肿瘤的发生发展,包括对免疫治疗的抵抗都跟人类患者十分相似。
不过,KPC小鼠的肿瘤,很少发生额外的突变,缺少肿瘤新抗原。为了让研究所用的小鼠模型跟人类患者更为相似,研究人员又向小鼠的肿瘤中引入了鸡卵清蛋白(OVA)作为肿瘤新抗原。
研究人员给小鼠肿瘤里引入新抗原OVA
引入了新抗原后,研究人员发现,在胰腺癌早期,小鼠肿瘤中浸润的淋巴细胞数量明显增多,肿瘤和周围的淋巴结里也出现了大量OVA特异性的T细胞,血液中也出现了抗OVA的抗体。引入的新抗原产生了明显的适应性免疫反应。
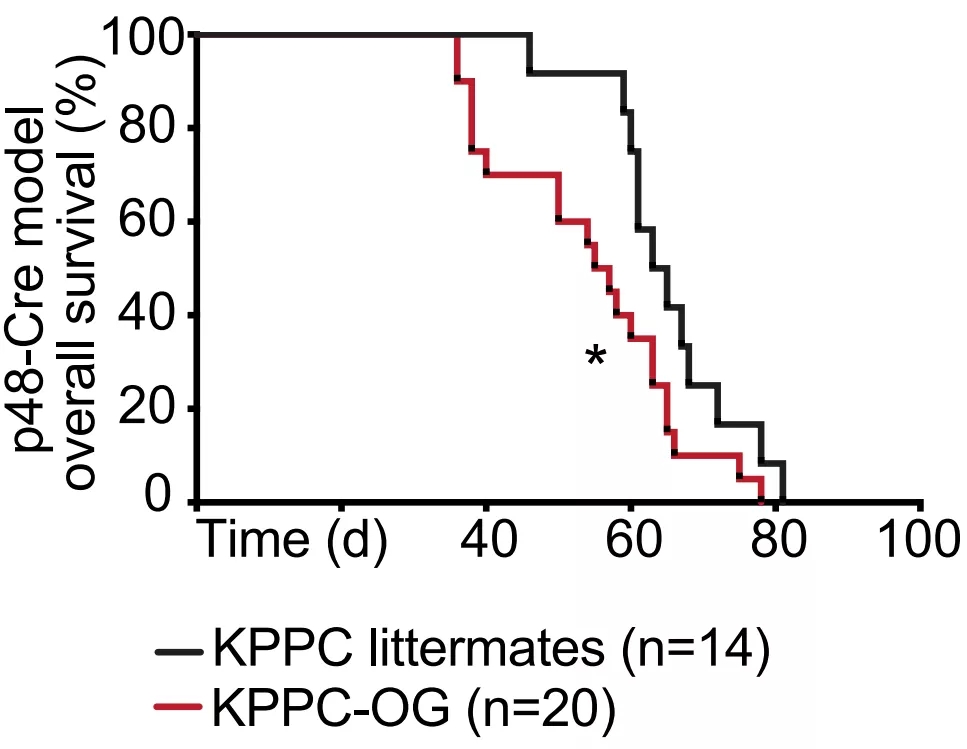
不过对新抗原的免疫似乎没能抑制住肿瘤的生长,反倒让肿瘤进展的更快了。引入了新抗原的小鼠,上皮内瘤变区域显著增多,病变程度更高,肿瘤细胞增殖更快。相比没引入新抗原的小鼠,引入新抗原反倒增加了肿瘤的肝转移,缩短了小鼠生存期。
新抗原缩短了小鼠生存期
研究显示,引入新抗原后,小鼠胰腺癌里胶原沉淀增多,α-平滑肌动蛋白阳性纤维密度增加,有丝分裂相关信号上调,炎性途径激活。同时,EGFR配体和粒细胞趋化因子增多,恶性细胞中ERK、STAT3和EGFR的磷酸化水平增加。
引入的新抗原改变了肿瘤微环境,促进了肿瘤进展和转移!
这跟研究人员预想的可不大一样。研究人员又向自发性肺癌小鼠肿瘤中引入了同样的新抗原OVA。这次的结果很符合预期,引入新抗原让肺癌小鼠肿瘤负担减少,疾病机制放慢,抑制了肿瘤生长。
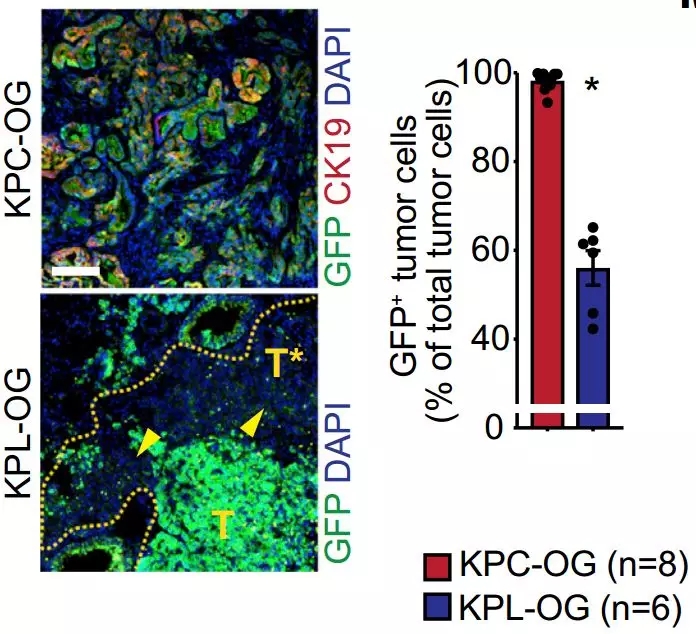
新抗原表达丢失也是肿瘤免疫逃避常用的策略之一,或许引入的OVA没有表达,无法引起免疫反应?不过研究结果显示,肿瘤中的OVA表达确实随着肿瘤进展有所减少,但无论是胰腺上的原发肿瘤还是肝脏上的转移瘤,都没有发生抗原丢失。
肿瘤中的新抗原没有丢失
接下来,研究人员又尝试对这些小鼠进行了免疫治疗。免疫检查点抑制剂,无论是PD-1单抗还是CTLA-4单抗,都对肿瘤无效。不过过继OVA特异性T细胞,再加上IL-2的辅助,却成功抑制了肿瘤生长,延长了小鼠生存期。
小鼠自己的T细胞,即使在免疫检查点抑制剂的帮助下,也没法杀死肿瘤,过继的T细胞却能杀死肿瘤,问题出在哪呢?
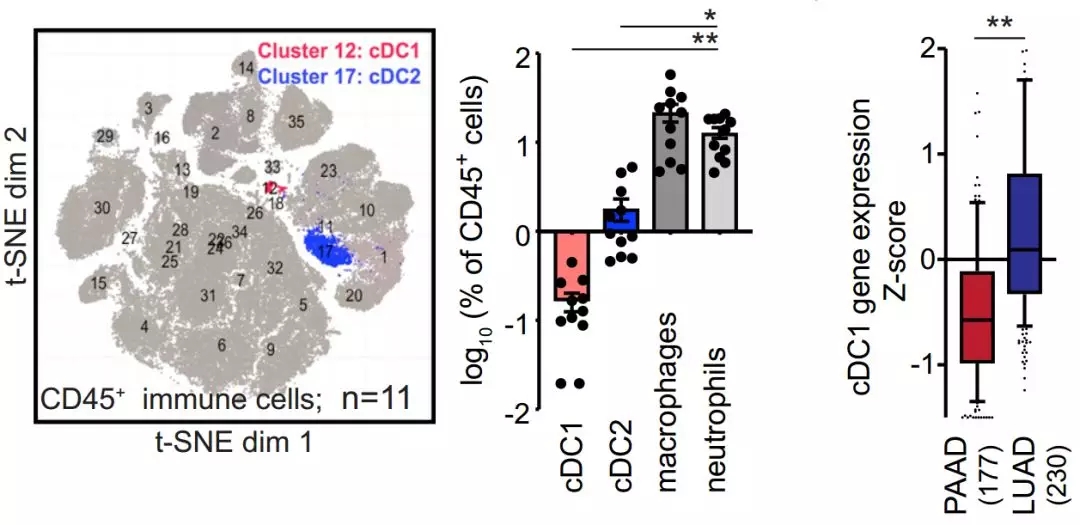
在对小鼠自发性胰腺癌和肺癌的免疫细胞分析中,研究人员发现,胰腺癌中的经典树突状细胞(cDC)比肺癌里少了很多。而且,胰腺癌中的cDC上共刺激分子和细胞成熟标志物表达较少,抗原呈递能力也较弱。对人类胰腺癌组织的分析也发现其中的树突状细胞较少。T细胞接收不到DC呈递的肿瘤抗原,自然也就不会去杀伤肿瘤了。
人体胰腺癌中,树突状细胞也很少
进一步研究还发现,缺少了树突状细胞,胰腺癌中CD4+ T细胞向Th17细胞分化,分泌促炎的IL-17,导致有利于肿瘤生长转移的微环境改变。
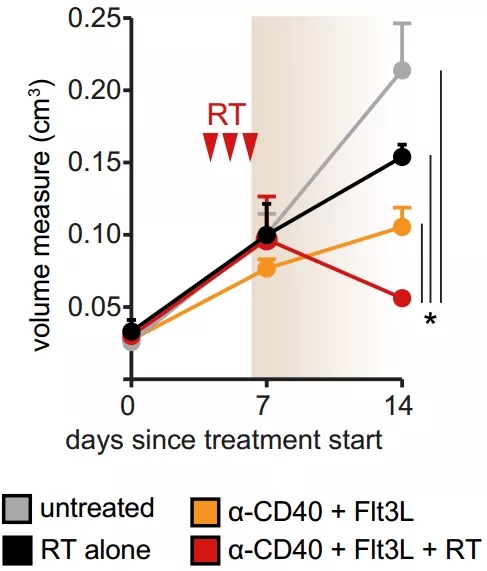
找到了问题就好办了。研究人员使用Flt3L增加cDC数量,在早期胰腺癌中确实逆转了新抗原引起的肿瘤基质改变和疾病进展加速。不过到了晚期肿瘤中,光靠Flt3L就不够了。研究人员又使用CD40抗体增强cDC功能,通过放疗充分释放肿瘤抗原。这一三联治疗成功让大多数小鼠体内的胰腺癌消退。
三联治疗让肿瘤消退
增加胰腺癌中树突状细胞的数量和功能大大改善了抗癌免疫。将来,这一方法还可能与免疫检查点抑制剂等免疫治疗方法联用,以改善它们的治疗效果,攻克癌王。
不过此前有研究发现,某些特定的新抗原有利于胰腺癌患者的预后[4]。这一研究所涉及的胰腺癌新抗原也只有人工引入的OVA一种,是否能将其推广到新抗原种类千变万化的临床实践中,还需要更多的研究。
参考文献:
1. Hegde S, Krisnawan V E, Herzog B H, et al. Dendritic cell paucity leads to dysfunctional immune surveillance in pancreatic cancer[J]. Cancer Cell, 2020, 37(3): 289-307. e9.
2. Bailey P, Chang D K, Forget M A, et al. Exploiting the neoantigen landscape for immunotherapy of pancreatic ductal adenocarcinoma[J]. Scientific reports, 2016, 6: 35848.
3. Bailey P, Chang D K, Nones K, et al. Genomic analyses identify molecular subtypes of pancreatic cancer[J]. Nature, 2016, 531(7592): 47-52.
4. Balachandran V P, Łuksza M, Zhao J N, et al. Identification of unique neoantigen qualities in long-term survivors of pancreatic cancer[J]. Nature, 2017, 551(7681): 512-516.
头图来自wikimedia.org