NEJM重磅:创造历史!免疫治疗首次取得晚期肝癌一线治疗成功,患者1年生存率达67.2% | 临床大发现
肿瘤免疫治疗,迈出了对中国患者意义非凡的一步。
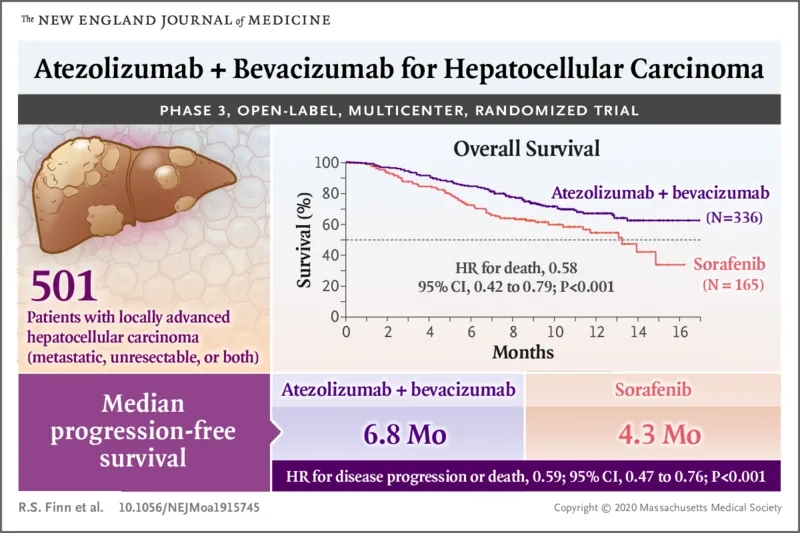
在发表的最新一期《新英格兰医学杂志》上,临床III期试验IMbrave150的完整数据正式公布:PD-L1抑制剂阿替利珠单抗(Atezolizumab),联合抗血管生成药贝伐珠单抗,取得了晚期肝癌一线治疗的成功。
与目前的标准治疗索拉非尼相比,阿替利珠单抗+贝伐珠单抗T+A的免疫联合治疗方案,显著延长了患者总生存期(OS)和无进展生存期(PFS)两项数据,患者的12个月生存率提高到67.2%,更是突破了肝癌治疗十多年来的瓶颈[1]!
T+A方案的成功意义之大,奇点糕还真的很难用一个词去概括。也是,如果不细讲中国肝癌患者之多、肝癌治疗之难、IMbrave150试验数据之精彩,又怎么能体现免疫治疗迈出这一步的价值呢?
“大魔头”之威
“肝癌大国”,对中国而言是一个沉甸甸的名号。
根据世卫组织2018年发布的全球癌症统计报告(Globocan 2018),中国每年新发的肝癌达到39.3万例,死亡病例则有36.9万例,这两个数字不仅让肝癌在中国位居恶性肿瘤发病率第四、死亡数第二,更是占到了全球肝癌的50%以上[2-3]。
中国的肝癌发病率如此之高,主要与病毒性肝炎有关,其中乙肝相关的肝癌,占到全部肝癌的65%以上[3]。此外致癌物黄曲霉素、饮酒导致的酒精肝、肥胖相关的脂肪肝这些,也都是肝癌发病的危险因素。
然而发病率高,还只是肝癌在中国棘手的原因之一,另一大原因就是患者的生存率低。中国肝癌患者的5年生存率,目前只有约12%,在所有常见癌症中排名倒数第二,仅仅高于胰腺癌[4],患者生存期也在肝癌整体高发的东亚垫底[5]。
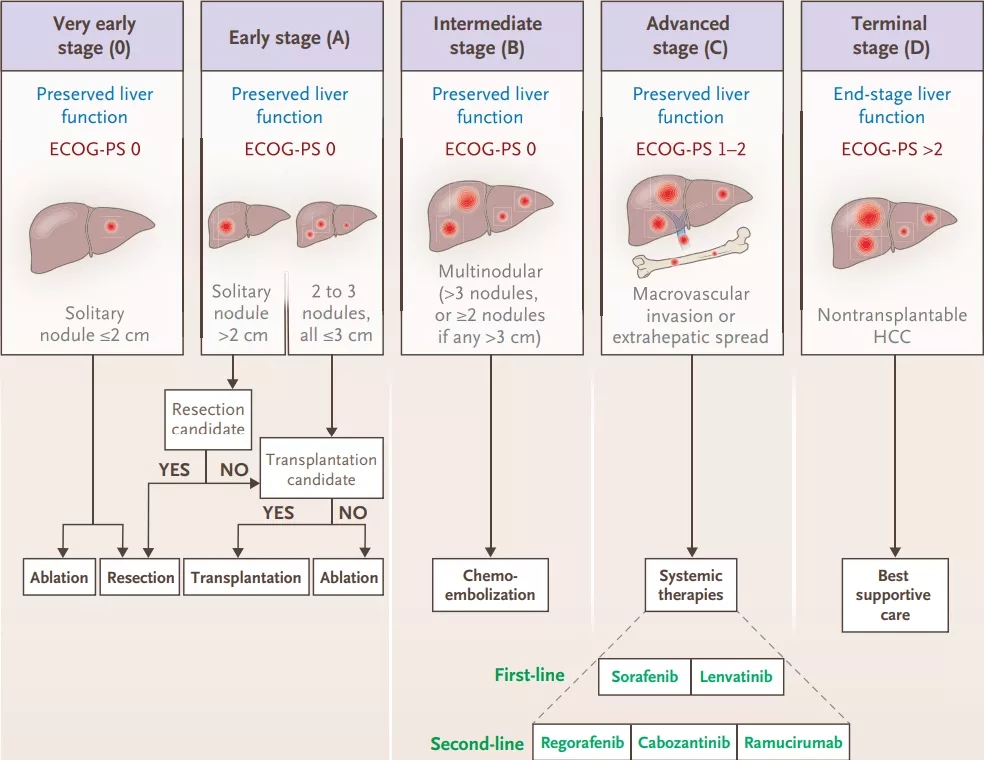
如此之低的生存率,很大程度是因为中国还缺少有效的肝癌筛查体系,50%以上的肝癌患者确诊时就已是晚期[6]。任何癌症,到了晚期都不好治。
而晚期肝癌,偏偏又是出了名的一颗“铜豌豆”,对系统性的放化疗是“软硬不吃”,没有任何一种方案能得到权威指南的推荐。目前临床的治疗基本以介入治疗和多靶点TKI药物为主,但效果比较局限,患者的中位生存期只有一年左右[7]。
虽然临床上有时候会放宽晚期肝癌的手术指征,但治疗仍然很难实现效果的飞跃
(图片来源:NEJM)
至于长期生存甚至治愈,靠目前的手段太难实现了。患者如此之多,对新疗法的需求又很迫切,也难怪在很多癌症中所向披靡的PD-1/L1抑制剂们,会被寄予厚望了。
然而面对肝癌这个“大魔头”,免疫治疗一开始却在对决中吃了点小亏,这又是怎么一回事呢?
联合,才能实现飞跃
免疫检查点抑制剂给免疫系统松绑,攻击肿瘤的作用机制,现在都算是常识了,但此前几种PD-1抑制剂,在一线和二线单药治疗的临床III期试验却相继失利。
这与肝癌很强的免疫抑制环境有关。肿瘤微环境整体呈现的特点,是缺血缺氧pH低,癌细胞可以在这种环境中如鱼得水,但对于免疫细胞和正常细胞来说,这无异于一片难以生存的绝地,肝癌常合并的肝脏炎症,更加剧了这一点。
不过免疫检查点抑制剂,也不是一定非要单枪匹马作战,现在的发展大方向,已经是联合治疗为主了。目前免疫联合治疗的方向主要有:双免疫检查点抑制剂联合、免疫检查点联合放化疗、免疫检查点联合抗血管生成药物等。
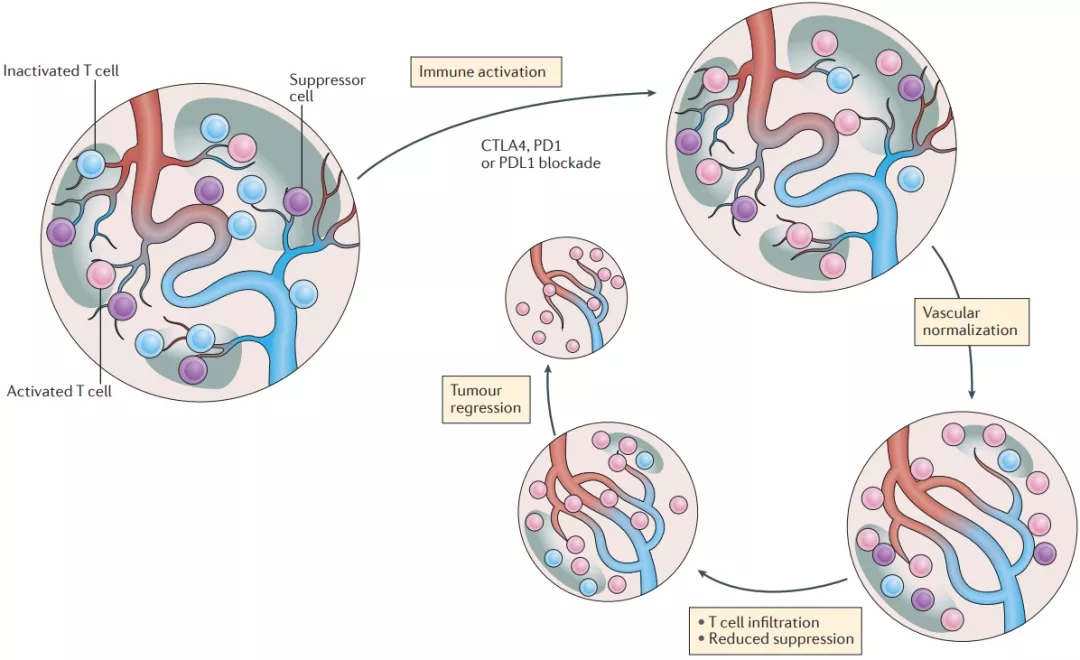
而其中在破解肝癌的免疫抑制环境上,免疫+抗血管方案的机制可是被寄予厚望的,因为肿瘤大量的新生血管,正是导致免疫抑制的重要原因。比如说,新生血管的结构特殊、容易渗漏,使抗癌药物和免疫细胞很难抵达肿瘤部位。
而就算免疫细胞能够浸润进肿瘤,缺氧和酸性微环境,也会显著抑制它们的战斗力。而且介导新生血管生成的VEGF等分子,还可以通过激活免疫抑制细胞等途径,抑制免疫应答[8]。
肿瘤异常的新生血管,对免疫应答的抑制机制
(图片来源:Nature Reviews Clinical Oncology)
VEGF正是许多抗血管生成药物的作用位点,所以早就有人提出用靶向治疗使“血管正常化”,改善免疫治疗的效果。再加上在肝癌治疗中的丰富使用经验,免疫+抗血管治疗方案出现得顺理成章。
而且近年来的研究还显示,免疫治疗激活的抗肿瘤免疫应答,本身就能起到一定的血管正常化作用,而且可以通过正反馈通路不断放大这种效果,所以免疫检查点抑制剂和抗血管生成药物,其实是互帮互助的[9-10]。
老规矩,1+1要>2才最好
(图片来源:Nature Reviews Immunology)
总而言之,免疫+抗血管联合治疗,就是要创造最有利于免疫细胞发挥的环境。分析显示,与贝伐珠单抗单独使用相比,T+A方案治疗可以增加CD8+T细胞对肿瘤的浸润,同时使癌细胞暴露更多的新抗原,显著提升了治疗的客观缓解率[11]。
在肝癌中进行的早期试验GO30140结果显示,T+A方案一线治疗不可切除肝癌患者的客观缓解率达到36%,其中有12%是完全缓解,患者的中位生存期达到17.1个月,12个月生存率高达63%[12]。
早期数据就这么漂亮,也难怪IMbrave150试验的结果被无数人翘首以待了,这次登顶NEJM,T+A方案到底交出了怎样的答卷呢?
创造历史
在评价一项临床试验的结果之前,设计的介绍也必不可少。IMbrave150试验也是一项跨国多中心的III期试验,总共入组了501名患者,按照2:1的比例分配到T+A免疫联合治疗组和索拉非尼单药治疗组。
T+A联合治疗的给药很简便,在每个21天治疗周期的第一天,静脉注射阿替利珠单抗和贝伐珠单抗就可以,而索拉非尼则是要每天口服。试验的主要终点自然是总体生存期(OS),此外还有无进展生存期(PFS)、客观缓解率(ORR)等。
IMbrave150试验的初步结果,最早公布在了2019年的欧洲肿瘤内科学会亚洲大会(ESMO Asia)上。当时的初步数据显示:与目前一线治疗的标准方案索拉非尼单药相比,T+A方案使患者死亡风险相对下降了42%[13]。
在疾病进展风险方面,T+A方案的数据也差不多,患者的中位无进展生存期(PFS)从4.3个月提升到了6.8个月。而且值得注意的是,T+A方案显著延缓了患者报告生活质量因病恶化(TTD)的时间。
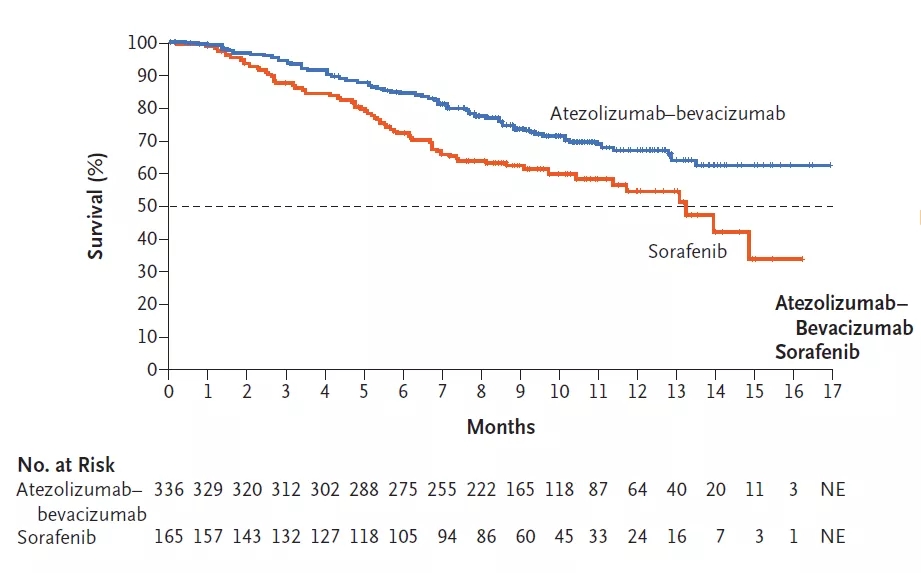
而在本次NEJM正式刊发的论文中,揭晓了备受瞩目的患者12个月生存率(12 Month OS%)数据:T+A组患者12个月生存率,达到67.2%!这一数据,也成功突破了不可切除肝癌一线治疗生存期的瓶颈。
两组患者的OS情况对比
(图片来源:NEJM)
预计缓解时间超过6个月的患者,在T+A组占87.6%,远高于索拉非尼组的59.1%,体现了免疫治疗“一旦缓解,就有望长效获益”的特点。随着后续更长期的随访数据成熟,相信免疫联合治疗在晚期肝癌上的持续获益也会更明确。
而在安全性数据上,T+A方案的表现也不错,治疗相关不良事件(AEs)的发生率,与索拉非尼单药治疗基本相当,不良事件的类型也与两种药物单独使用时比较相似,可以用此前的经验进行管理。
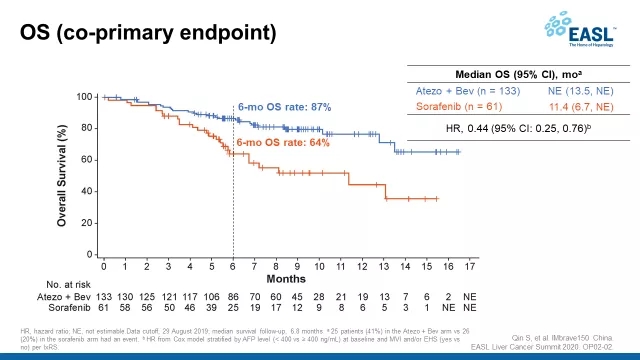
此外今年初的欧洲肝脏研究学会(EASL)肝癌峰会上,IMbrave150试验中国亚组的数据,也提示T+A可能会更适合中国患者的治疗。这项分析中包括了194名中国患者,人数多,结论就有说服力。
数据显示[13],在患者整体有着更高的乙肝感染率、大血管侵犯/肝外转移、甲胎蛋白≥400ng/ml等多种预后不良因素的状态下,中国亚组患者OS的HR值为0.44,患者6个月生存率达到86.6%,意味着疗效比试验整体人群更出色!
一目了然
(图片来源:2020 EASL Liver Cancer Summit)
IMbrave150试验的成功,可以说给肝癌的治疗史翻开了全新的一页,数据如此出色,这么说一点都不夸张。目前T+A方案一线治疗肝癌的适应症,也在通过多个快速审批通道交由FDA审批,有望成为全球首个获批的肝癌一线免疫疗法。
奇点糕常说的一句话,是坚持就有希望。表现如此出色的肝癌免疫治疗,离走进中国也不远了,坚持下去不放弃,才能等到TA的冲锋号啊。
参考资料:
1.https://www.nejm.org/doi/full/10.1056/NEJMoa1915745
2.https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
3.Fan J H, Wang J B, Jiang Y, et al. Attributable causes of liver cancer mortality and incidence in china[J]. Asian Pacific Journal of Cancer Prevention, 2013, 14(12): 7251-7256.
4.Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567.
5.Yang J D, Hainaut P, Gores G J, et al. A global view of hepatocellular carcinoma: trends, risk, prevention and management[J]. Nature Reviews Gastroenterology & Hepatology, 2019, 16(10): 589-604.
6.Park J W, Chen M, Colombo M, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study[J]. Liver International, 2015, 35(9): 2155-2166.
7.Villanueva A. Hepatocellular Carcinoma [J]. New England Journal of Medicine, 2019, 380(15): 1450-62.
8.Fukumura D, Kloepper J, Amoozgar Z, et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges[J]. Nature Reviews Clinical Oncology, 2018, 15(5): 325.
9.Tian L, Goldstein A, Wang H, et al. Mutual regulation of tumour vessel normalization and immunostimulatory reprogramming[J]. Nature, 2017, 544(7649): 250-254.
10.Huang Y, Kim B Y S, Chan C K, et al. Improving immune–vascular crosstalk for cancer immunotherapy[J]. Nature Reviews Immunology, 2018, 18(3): 195-203.
11.Wallin J J, Bendell J C, Funke R, et al. Atezolizumab in combination with bevacizumab enhances antigen-specific T-cell migration in metastatic renal cell carcinoma[J]. Nature Communications, 2016, 7: 12624.
12.Lee M, Ryoo B Y, Hsu C H, et al. Randomised efficacy and safety results for Atezolizumab (Atezo)+ bevacizumab (Bev) in patients (PTS) with previously untreated, unresectable hepatocellular carcinoma (HCC)[J]. Annals of Oncology, 2019, 30: v875.
13.Qin S, et al. IMbrave150 China. EASL Liver Cancer Summit 2020. OP02-02.