TIGIT+PD-L1“王炸”组合!治疗非小细胞肺癌缓解率翻倍,且安全风险未增加
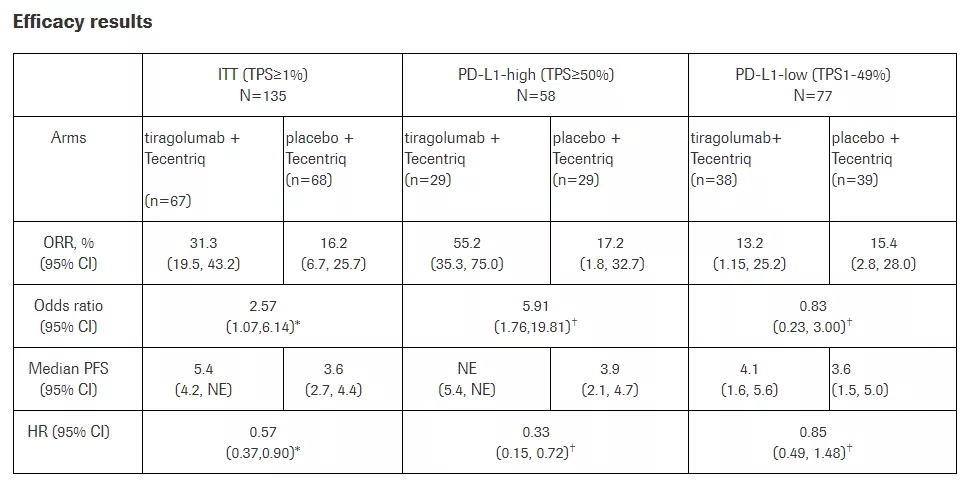
积极的研究数据:缓解率翻倍达31.3%
TIGIT靶点介绍
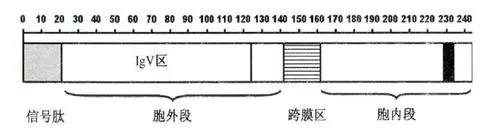
TIGIT,全称为T细胞免疫球蛋白和ITIM结构域蛋白,属于免疫球蛋白超家族(IgSF)。人TIGIT分子胞膜外区长141个氨基酸,有1个免疫球蛋白V样结构域; 跨膜区23个氨基酸;胞质区较短,有80个氨基酸,具有1个PDZ结合结构域和1个ITIM模体。
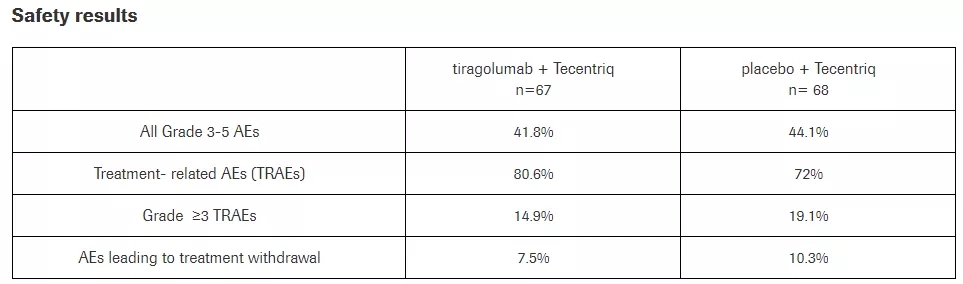
安全性对比(图片来源:cnki)
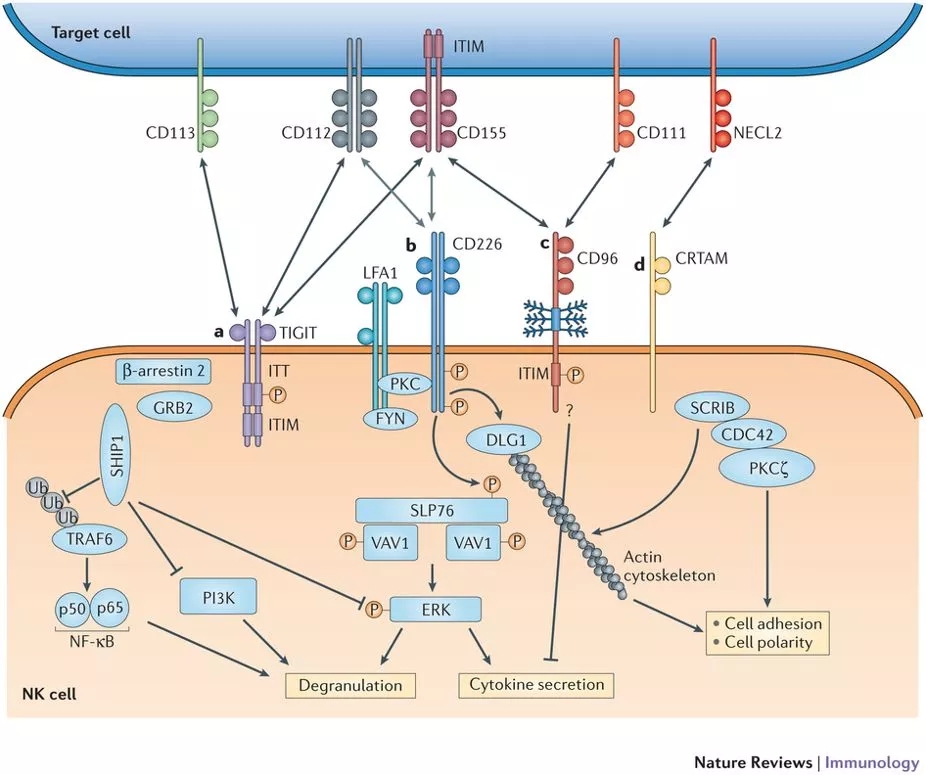
TIGIT信号通路(图片来源:Ludovic Martinet et al. 2015)
CD155过表达促进肿瘤细胞侵袭和迁移,并与肿瘤进展和预后不良有关。作为共刺激受体CD226和天然杀伤细胞和T细胞上的共抑制受体TIGIT和CD96的配体,CD155似乎在免疫中发挥双重作用。一些研究表明CD155过表达可能诱导肿瘤免疫逃逸。
在TIGIT抗体领域走在前列的公司
目前,国内外布局TIGIT抗体的公司且不少,罗氏处于领先地位,两项适应症已经进入Ⅲ期临床阶段。以下,小编盘点了一些国内外进展较快的项目:
罗氏——Tiragulumab
Tiragulumab是罗氏重点开发的TIGIT单抗,在2019年财报中公布了八项围绕Tiragolumab的关键性临床项目,目前在小细胞肺癌和NSCLC两个适应症上都进入在III期临床试验阶段。
近日,罗氏宣布将在ASCO 2020会议上公布Tiragulumab联合PD-L1药物Tecentriq作为一线疗法治疗NSCLC的研究数据。
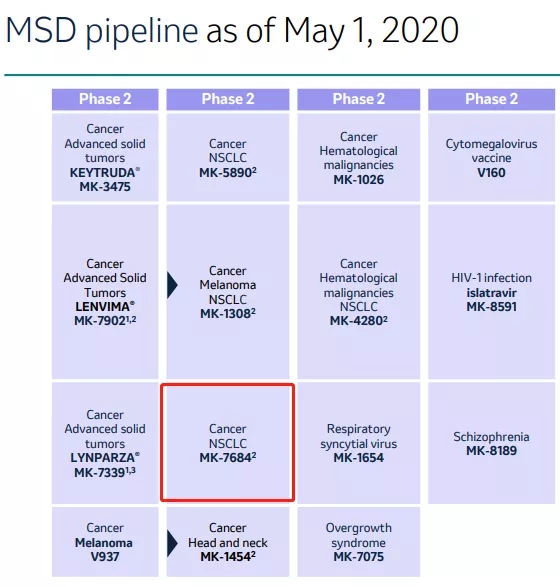
默沙东——MK-7684
默克公司(Merck)开发的抗TIGIT候选药物MK-7684处于Ⅱ期临床(NCT02964013)以评估作为单一疗法或与Pembrolizumab联合用于转移性实体瘤的安全性,疗效和药代动力学(NCT02964013)。
此前该公司在2018年第三届SITC年会上公布了其 I 期早期数据,有68位患者入组的临床试验中(34位患者为单药治疗,其余34例为联合治疗患者)。结果显示,在这两组中分别观察到1个PR和8个PR,疾病控制率分别为35%和47%。
BMS——BMS986207
BMS公司的BMS-986207是一款靶向TIGIT的抗体药物,目前正在实体瘤患者中进行临床试验(NCT02913313),以评估BMS-986207单药和与Nivolumab(Opdivo)联用的安全性和有效性。
Arcus Biosciences——AB154
Arcus的TIGIT抗体AB15也已进入II期试验,用于治疗NSCLC。
不久前,据彭博社报道吉利德科学准备收购IO企业Arcus的部分权益,但具体内容不详。据悉吉利德很可能是看中了Arcus的主要资产AB154。
OncoMed——OMP-313M32
Etigilimab(OMP-313M32)是由由OncoMed和Celgene公司合作开发的人源化TIGIT单抗,于2017年进入I期临床试验(NCT03119428),主要评估该单抗单药或与抗PD-1 单抗(Nivolumab)联合治疗晚期恶性肿瘤的安全性和耐受性。
在2017年美国癌症研究协会年会上,OncoMed从多项临床前试验中获得了一些积极成果,但Ib期临床试验在2019年9月由于主办方的原因宣布终止。
信达生物——IBI-939
IBI939是由信达研发的国内首个TIGIT抗体,可与TIGIT结合并阻断其与CD155的相互作用,增强免疫活化。
2020年1月6日,Insight 数据库显示,信达的1类新药 IBI939 获批临床,拟用于治疗晚期肿瘤(血液肿瘤和实体瘤)。
百济神州——BGB-A1217
百济神州在研TIGIT单克隆抗体BGB-A1217目前正在澳大利亚启动一项BGB-A1217联合替雷利珠单抗用于治疗晚期实体瘤患者的Ⅰa/Ⅰb期临床试验(NCT04047862),以研究联合用药安全性、耐受性、药代学以及初步抗肿瘤活性。
此外,Potenza Therapeutics与安斯泰来合作开发ASP8374,与Pembrolizumab(Keytruda)联用,目前临床试验在Ⅰ期阶段。Iteos Therapeutics的EOS884448也进入Ⅰ期临床,临床前研究表明,EOS8884448可以恢复T细胞的功能。
国内君实生物的JS006,复宏汉霖的HLX53,思坦维生物的mab-7还处于临床前阶段,拟用于实体瘤治疗。
参考资料:
1.https://www.roche.com/media/releases/med-cor-2020-05-14.htm
2.https://www.roche.com/research_and_development/who_we_are_how_we_work/pipeline.htm
3.何文涛,陈茜,余学峰.共抑制分子TIGIT的研究进展[J].现代免疫学,2014,34(5):436-438.
4.Martinet L, Smyth MJ. Balancing natural killer cell activation through paired receptors. Nat Rev Immunol. 2015 Apr;15(4):243-54
5.各公司官网
6. 佰傲谷BioValley:免疫检查点新秀---TIGIT抗体的研发格局