《自然·医学》:肿瘤一出现,全身T细胞都遭难!科学家发现,肿瘤损害抗原呈递细胞功能,导致全身T细胞活性被抑制,手术切除可逆转
肿瘤虽然长在特定的组织和器官,但是它的“负能量”非常大,甚至能影响全身。
前不久,加州大学旧金山分校Matthew H. Spitzer领衔的研究团队,在著名期刊《自然·医学》上发表的研究成果表明[1]:肿瘤对免疫的破坏能力不局限于肿瘤微环境本身,还会对全身的免疫系统造成广泛和可变的破坏;不过这种全身性的免疫压制,可以通过手术切除肿瘤实现逆转。
这个研究成果对如何以及何时给癌症患者开展免疫治疗有一定的指导意义。
▲ 论文截图
免疫治疗大家都不陌生了,它的出现改变了很多癌症患者的命运。不过,要想让更多的患者从免疫治疗中获得益处,科学家仍需更广泛地了解制约癌症免疫反应的因素。
从当前的免疫治疗模式来看,治疗的思路主要聚焦在肿瘤内的杀伤性T细胞上,但是近年来已经有很多研究表明,肿瘤微环境内杀伤性T细胞的功能障碍是不可逆转的[2],而全身性抗肿瘤免疫反应对免疫治疗效果至关重要[3,4]。
不过,目前还缺乏关于癌症发展如何影响全身免疫状态的全面研究。
为了更全面、系统、深入和动态地了解肿瘤的进展对全身免疫系统的影响,Spitzer和他的同事首先利用最新的质谱流式细胞技术,对8种癌症模式小鼠肿瘤中免疫细胞亚群做了动态且系统地分析。
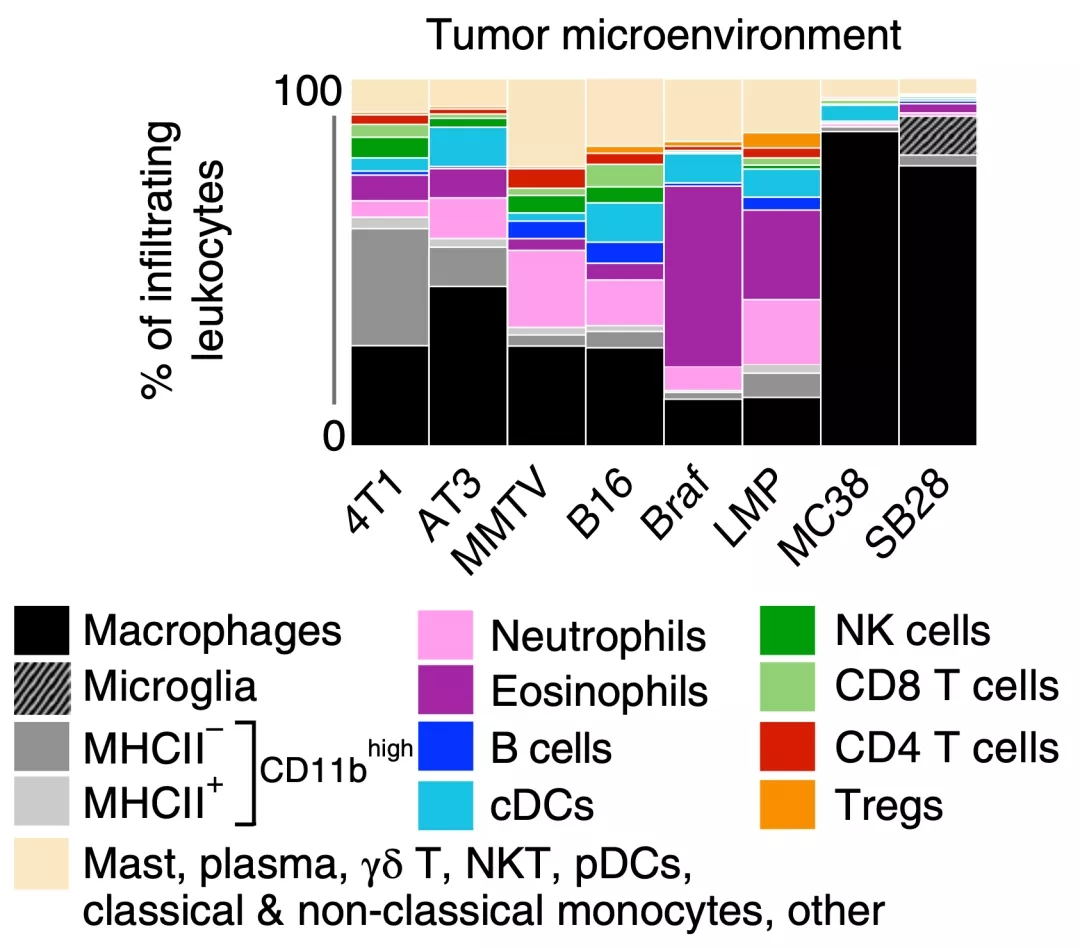
他们发现肿瘤微环境的免疫成分在不同肿瘤模型之间差异显著。总的来看,肿瘤相关巨噬细胞在各种肿瘤中占比都非常大,但具体到各个肿瘤之间占比差异较大。
例如,MC38结直肠癌和SB28胶质母细胞瘤模型中,适应性免疫细胞相对较少;LMP胰腺癌和遗传诱导的Braf/Pten黑色素瘤模型均有广泛的嗜酸性粒细胞浸润;B16黑色素瘤和3种乳腺癌模型(4T1、AT3以及自体MMTV-PyMT)表现出局部免疫细胞相对丰度较低,但多样性较高的特点。
▲ 不同肿瘤模型之间肿瘤微环境的免疫状态差异
这也说明,不同的肿瘤之间免疫状况差异非常大。
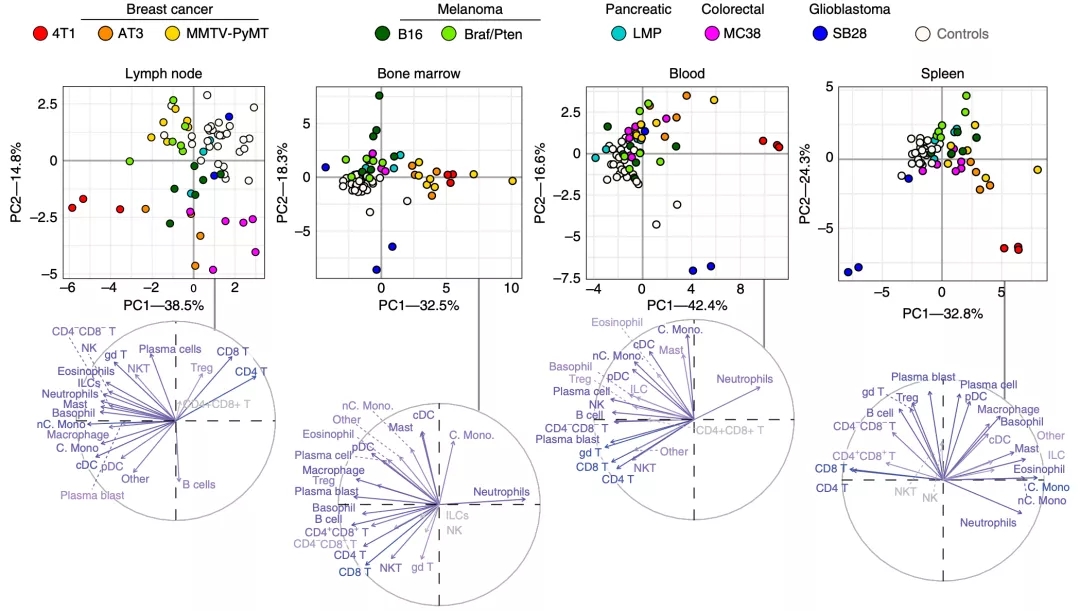
既然肿瘤微环境中免疫状况差异如此之大,那么这些肿瘤是否也会导致全身性免疫系统出现变化呢?于是,他们随即又分析了模式小鼠血液、脾脏、骨髓和肿瘤引流淋巴结中免疫细胞亚群状况。
结果发现,与对照组相比,肿瘤模式小鼠的全身免疫状况确实发生了变化,不同的肿瘤类型之间也存在一定的差异。
最让Spitzer团队惊讶的是,定位于大脑的SB28胶质母细胞瘤,竟然对全身免疫免疫有非常大的影响,这种影响甚至超过其他肿瘤。
▲ 不同肿瘤模型的其他免疫组织/器官的免疫状态差异
Spitzer和他的同事还注意到,无论肿瘤有没有发生转移,这种全身性的免疫改变都存在,而且在MMTV-PyMT乳腺癌模型中还与原发肿瘤大小紧密相关。
总体来看,肿瘤对全身性免疫的重塑,78.4%可以用肿瘤的大小解释,剩下的部分与肺和淋巴结转移均相关。
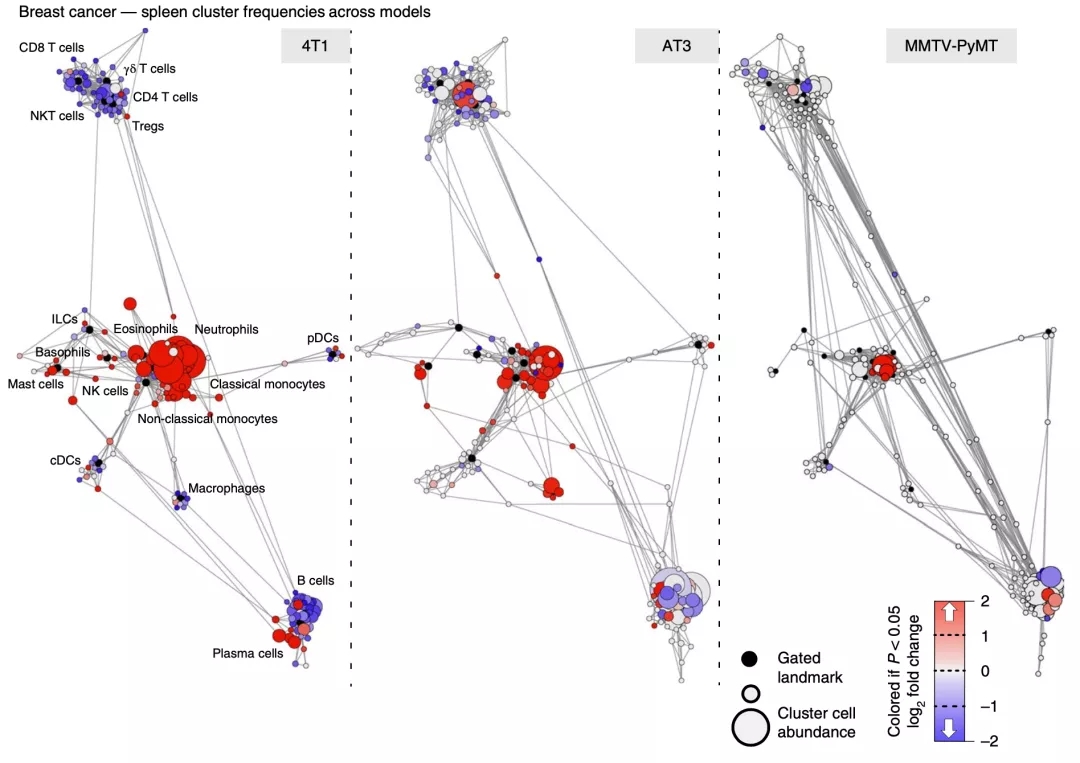
具体到脾脏来看,乳腺癌对脾脏免疫的重塑导致中性粒细胞、嗜酸性粒细胞和单核细胞的频率增加,B细胞和T细胞减少。
基于以上数据,研究人员认为,肿瘤负担广泛地破坏了免疫宏观环境,这个研究结果对旨在激活局部与全身免疫反应的治疗有一定的参考价值。
▲ 乳腺癌模型的脾脏免疫状态变化
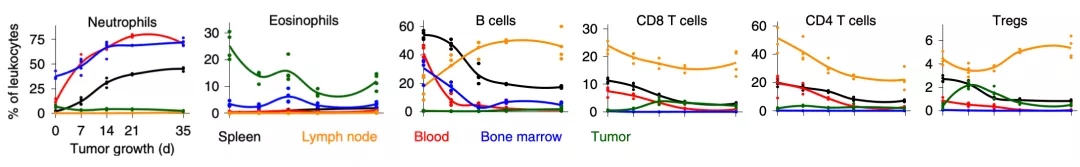
动态分析数据发现,随着肿瘤的生长,肿瘤微环境、血液、脾脏、骨髓和肿瘤引流淋巴结中免疫细胞亚群呈非线性变化。
而且肿瘤内的免疫动态变化与其他部位的也不相同,拿中性粒细胞来说,脾脏和骨髓中的中性粒细胞增多,一段时间之后血液中水平也会升高,但淋巴结或肿瘤内几乎一直水平较低。其他免疫细胞随肿瘤生在的变化趋势可见下图。
这表明,肿瘤的免疫反应是一个高度动态的过程。
▲ 随着肿瘤的生长,不同免疫细胞在不同组织器官中的变化
接下来,Spitzer团队考虑的问题是,这种动态的变化具体到不同的T细胞亚型又是如何变化的呢?
研究人员首先关注的肿瘤浸润性CD103+ 调节性T细胞(Tregs)的变化,因为CD103+ Tregs是一种强效的杀伤性T细胞的抑制性T细胞[5]。CD103+ Tregs在肿瘤生长到第7天时,在肿瘤微环境中含量非常丰富,但随着肿瘤的进展逐渐减少。不过CD103+ Tregs在引流淋巴结中的变化是逐渐增多。
此外,CD44+CD27+记忆性CD4+T细胞在脾脏中变化最大,随肿瘤的进展而减少;血液中表达CD31黏附受体的活化CD44+CD4+T细胞增加,可促进T细胞在炎症环境中的生存;在淋巴结中扩张的CD44+CD8+T细胞表达Ly6C,可支持中央记忆型T细胞的淋巴结归巢;CD8+T细胞在各种肿瘤模型中都存在扩张,但最主要的亚群是与T细胞功能障碍有关的PD-1和CD69高表达亚群。
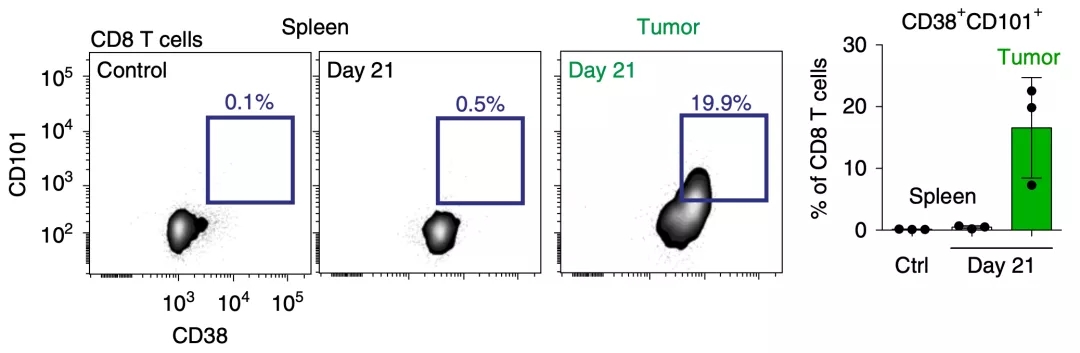
为了搞清楚T细胞功能障碍的程度,Spitzer和他的同事分析了瘤内和脾脏T细胞的CD101和CD38的表达水平,这两个标志物最近被确定为永久性T细胞功能障碍的象征[2]。
结果表明,在晚期肿瘤组织中有大量CD38+CD101+CD8+T细胞聚集,这和之前的研究基本保持一致;然而,这种表型T细胞并没有在脾脏中聚集,这表明CD8+T细胞在肿瘤微环境和其他免疫组织中的改变不同。
▲ 肿瘤中永久性障碍的T细胞逐渐聚集,但是脾脏没有这个现象
此外,研究人员还发现,在肿瘤的发展过程中,PD-1和PD-L1表达也是动态性的,这暗示在不同的时间点,肿瘤对免疫检查点抑制剂的敏感性可能存在差异。
既然肿瘤会影响全身性的免疫反应,那么这种影响究竟有多大呢?
Spitzer团队首先用病原物分别感染健康小鼠和荷瘤小鼠,发现正常小鼠和荷瘤小鼠都能清除体内的病原物,这说明肿瘤并没有完全抑制全身免疫反应。
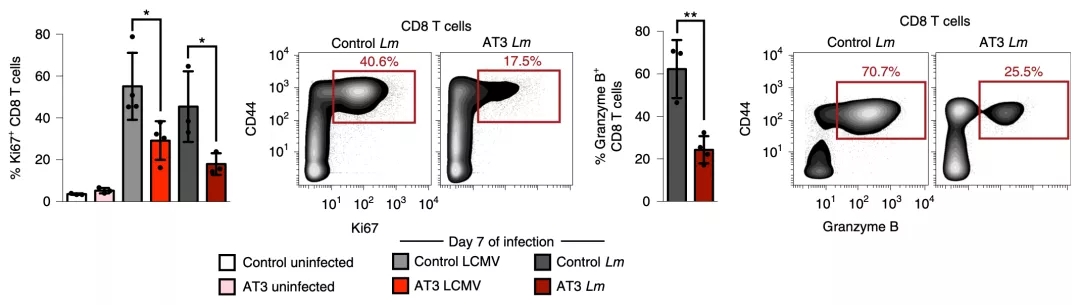
不过当研究人员仔细分析两种小鼠的CD8+ T细胞的分化、增殖和产生细胞毒性物质的能力的时候,差异还是出现了,而且是非常明显地出现了。
荷瘤小鼠的CD8+ T细胞明显要弱很多,如此看来肿瘤确实是损害了免疫反应。
▲ 荷瘤小鼠T细胞增殖等标志物低
基于以上研究,我们能发现,在肿瘤的影响下,其他免疫组织中的CD8+ T细胞没有出现功能障碍,但是增殖、分化等能力下降。这暗示可能是抗原呈递细胞(APC)活性受损导致肿瘤之外的地方CD8+ T细胞的活化水平低。之前也有研究表明,乳腺癌患者的循环树突状细胞的抗原呈递能力降低[6]。
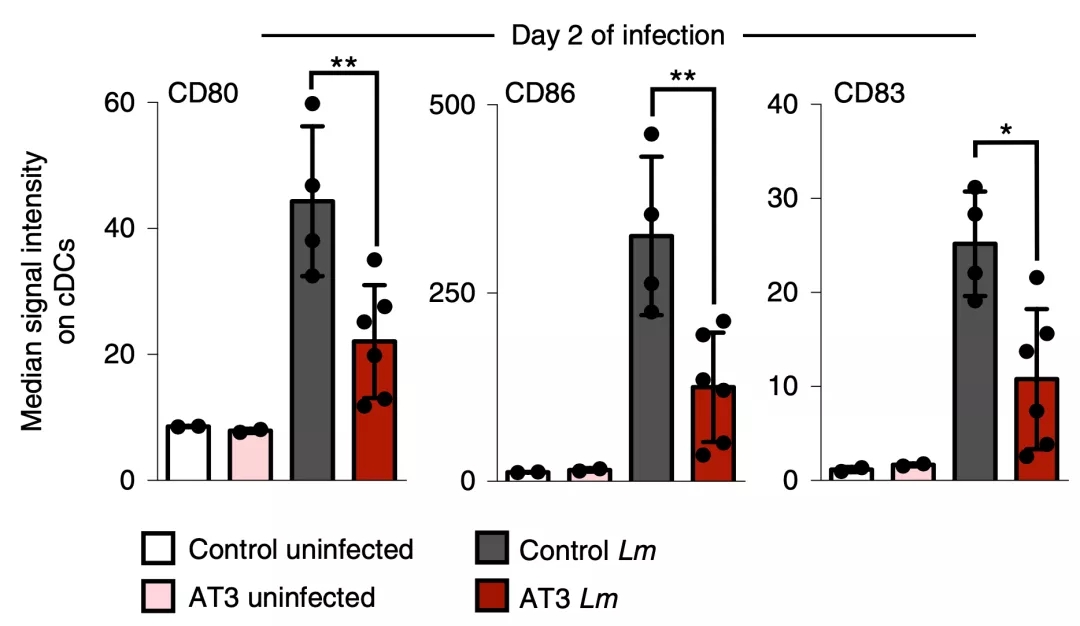
Spitzer和他的同事分析了脾脏树突状细胞上的共刺激分子表达情况,在荷瘤小鼠体内,树突状细胞的关键共刺激分子CD80和CD86,以及活化标志物CD83表达水平都非常低。
▲ 肿瘤对树突状细胞关键标志物的影响
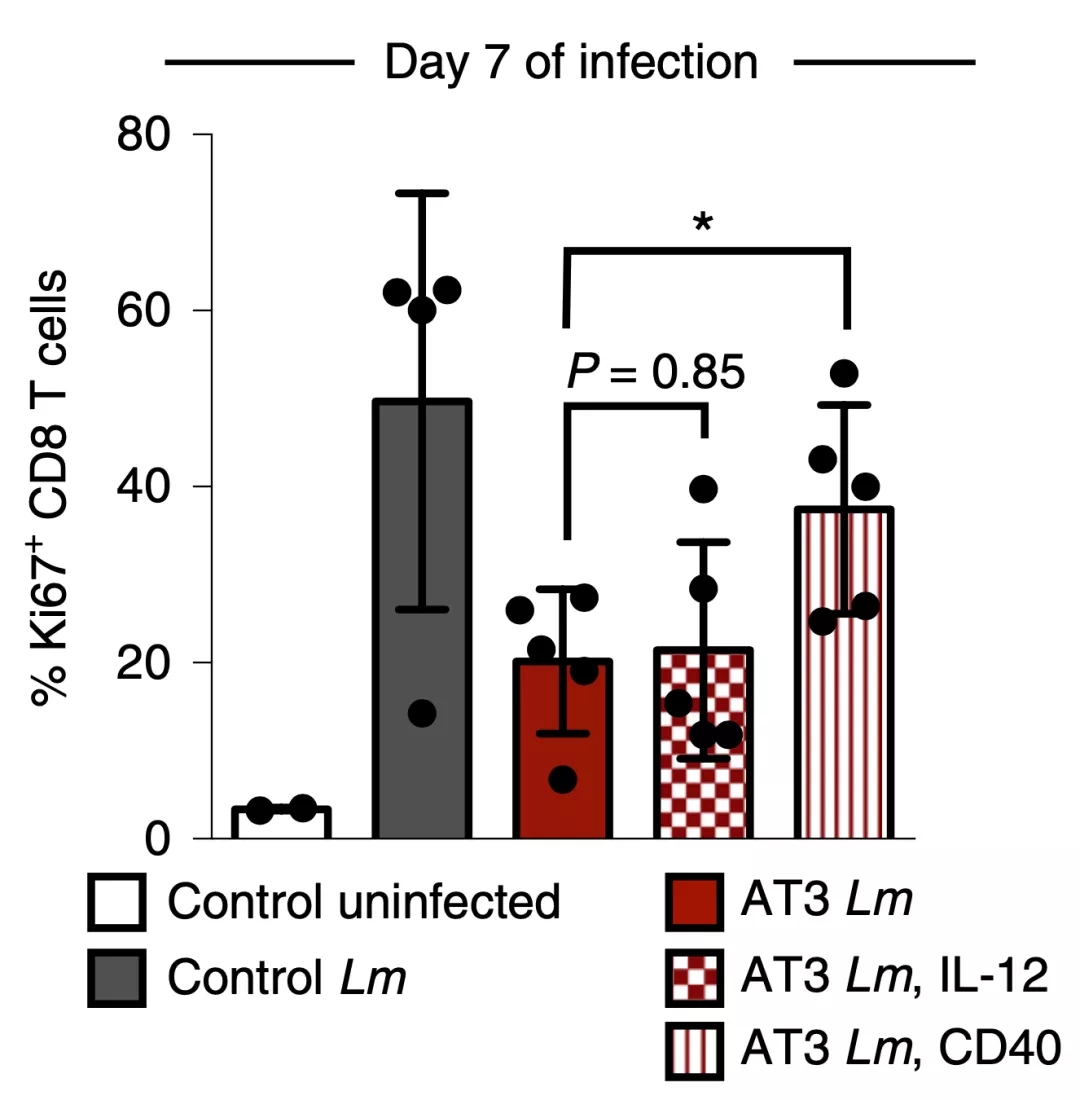
用抗CD40抗体等激活抗原呈递细胞的药物处理感染荷瘤小鼠之后,树突状细胞的活性就提高了,而且CD8+T细胞增殖水平也提高,相比之下,高剂量的IL-12或抗CTLA-4的治疗未能拯救T细胞增殖,这表明单独的T细胞靶向干预是不够的。
以上实验结果说明,在肿瘤负担的情况下,抗原呈递细胞由于受损,未能激发最佳的T细胞反应。
▲ 抗原呈递细胞活化药物的功效
鉴于T细胞活性的缺陷能在从肿瘤负担的环境中移除后被逆转,Spitzer和他的同事开始思考肿瘤清除是否足以逆转全身免疫的变化。
实验数据表明,成功切除肿瘤能逆转AT3和4T1乳腺癌和MC38结直肠癌模型全身免疫的变化,例如脾脏免疫细胞的占比和T细胞亚群的组成变化均恢复正常。
然而,如果存在局部复发或者转移的话,全身的免疫状态又会处于一种中间状态的表型。例如局部复发诱导的脾脏变化与原发肿瘤相似,但T细胞的组成变化不太显著。而肺转移诱导的变化相对比较温和,这也再次说明肿瘤对全身免疫的扰动主要不是播散性转移引起的。
病原物感染再次证实了上面的研究结果,手术切除肿瘤之后,CD8+T的增殖和细胞毒性与正常小鼠一致,但局部复发会减轻恢复的程度。
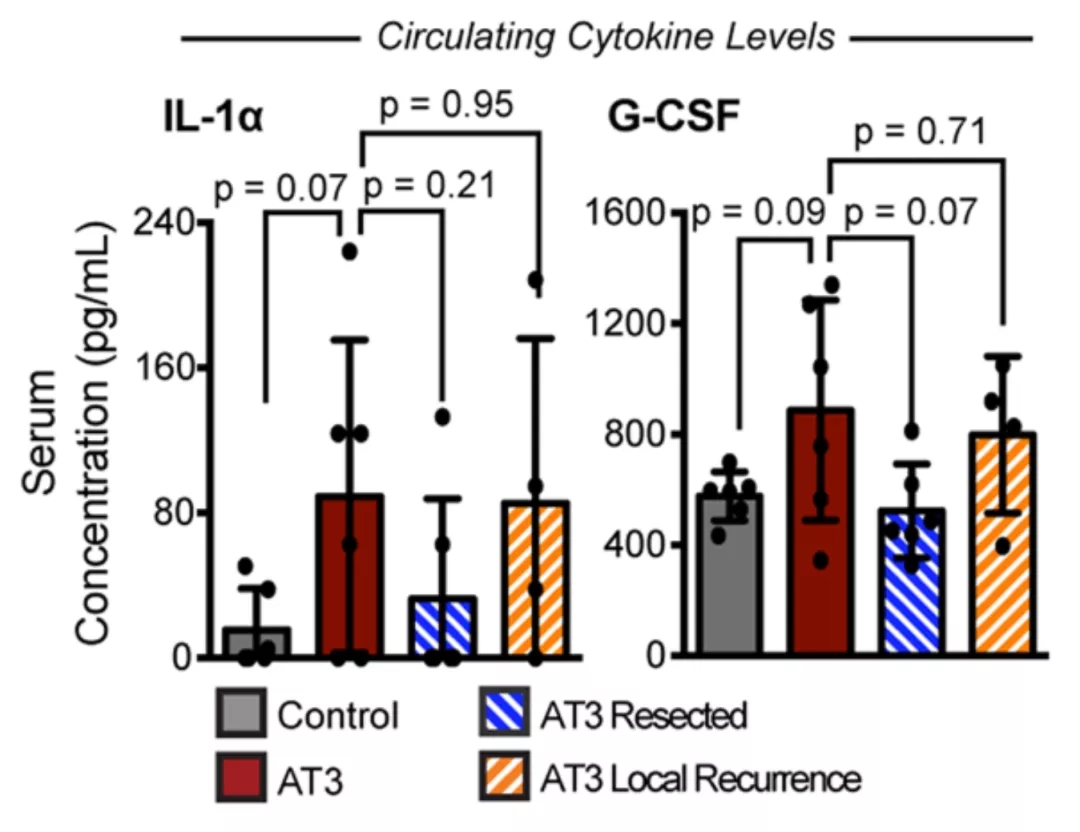
最后,研究人员还分析了肿瘤改变全身免疫的相关分子,将目标确定在炎症细胞因子IL-1α和粒细胞集落刺激因子(G-CSF)上,也就是说肿瘤中癌细胞产生的IL-1α和G-CSF,经外周血循环,影响了全身免疫反应。
▲ IL-1α和G-CSF的变化
最后来总结一下这个研究,研究人员认为,他们的研究成果表明系统性免疫状态是具有高度可塑性的。受生理环境的影响,免疫疗法在术前或术后使用,可能会产生不同的结果。
此外,将激活抗原呈递细胞的疗法与免疫检查点抑制剂联合使用,可能会激发更强大的抗癌免疫反应。据了解,已经有相关的临床研究正在开展中。