免疫系统人源化小鼠模型是通过将人的造血细胞、淋巴细胞或组织植入免疫缺陷小鼠体内,从而使其重建人类免疫系统的小鼠模型。它们可有效地重建人类免疫系统,更好地模拟人体免疫特征。
近交系小鼠由于其具有遗传背景一致、繁殖周期短并且基因修饰操作手段成熟等优势,已成为免疫学研究的重要动物模型。但是,毕竟啮齿动物和人类之间存在巨大的种属差异,人类病原体或针对人类细胞开发的药物也具有种属特异性,在免疫健全的小鼠模型中无法很好的模拟疾病的发生发展。
野生型小鼠的免疫系统对于来源于人的异种细胞和组织具有很强的排斥作用。而依赖于免疫缺陷小鼠的人肿瘤移植模型虽然已被广泛使用在肿瘤免疫及新疗法研发中,但由于缺乏人类免疫系统及肿瘤免疫微环境,很大程度上限制了免疫机制及免疫治疗的转化研究。因此,如何利用动物模型模拟人体肿瘤细胞与免疫系统之间的相互作用,也成为肿瘤免疫研究中至关重要的一环。
免疫系统人源化小鼠模型是指具有人类免疫系统、能够模仿人体免疫机能和病理表现的人源化小鼠模型,对于研究人类疾病和新型疗法的开发具有重要意义。
应该说,免疫系统人源化小鼠模型建立的前提是免疫缺陷小鼠的构建和不断优化发展。因为只有首先破坏受体小鼠的自身免疫系统,移植到其体内的人源组织或者细胞才能重建出具有功能的人源免疫系统。
从最早的裸鼠(nude),到后来的SCID小鼠和Rag-/-小鼠,再到NOD-scid小鼠,这些早期的免疫缺陷小鼠或由于固有免疫的存在导致人源细胞的植入成功率低,或由于对辐照高度敏感以及有限的生命周期,均不同程度地限制了免疫系统人源化小鼠在实际研究中的应用。
免疫缺陷小鼠的发展在2000年后迎来了里程碑式的突破。人们发现,干扰白细胞介素2 (IL-2)受体γ链(IL-2Rγc)的缺失不仅会导致小鼠T、B细胞发生严重缺陷,而且会干扰NK细胞的发育,从而能够进一步改善人源细胞在小鼠体内的移植效果。在此基础上,多种更为先进的重症免疫缺陷小鼠被世界各地的研究人员繁育出来,成为目前被广泛应用的免疫系统人源化小鼠模型宿主。包括:BALB/c-Rag2-/-γc-/-(BRG)、NOD/shi-SCIDγc-/- (NOG) 以及NOD/SCID-γc-/- (NSG)等等。
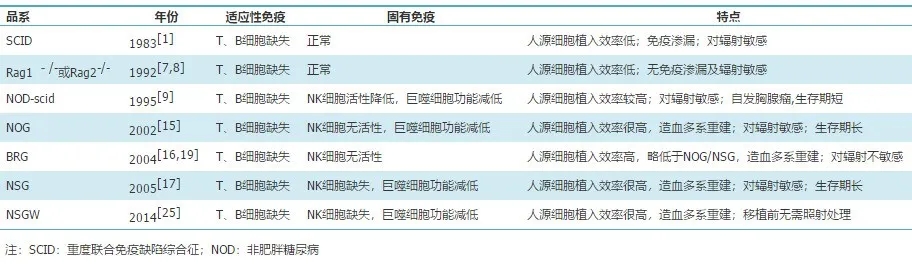
表1. 人源化小鼠模型的宿主及其特点 (表格来自Ref.1 )
由于种种原因,NSG小鼠目前在国内并无途径进行购买,为解决客户对该类品系的需求,南模生物自主研发了M-NSG小鼠,该品系是在NOD-SCID小鼠基础上敲除Il2rg基因,与NSG或NOG小鼠一样,缺乏成熟的T、B细胞和NK细胞,是目前免疫缺陷程度最高的小鼠之一。
依据人免疫系统重建的方法,可以将免疫系统人源化小鼠模型分为三大类:
-
Hu-PBMC (也叫 Hu-PBL) 小鼠模型 (humanized-peripheral blood mononuclear cells)
-
Hu-HSC 小鼠模型 ( humanized-hematopoietic stem cells )
-
Hu-BLT 小鼠模型 ( humanized-bone marrow, liver, thymus )
外周血单核细胞(Peripheral blood mononuclear cell,PBMC) 即外周血中具有单个核的细胞,主要由淋巴细胞(T或B细胞)、单核细胞、吞噬细胞、树突状细胞和其他少量细胞类型组成,是机体免疫应答功能的重要细胞组成。
Hu-PBMC 模型,或者被称为 Hu-PBL(perihperal blood lymphocyte, PBL)模型,是一种构建较为简单和经济的免疫系统人源化小鼠模型。其构建方式是将成熟淋巴细胞(来自PBMC)经腹腔(i.p.)或静脉(i.v.)注射到免疫缺陷宿主小鼠中,该模型常被用于研究人效应T细胞的活化以及评估免疫抑制药物。
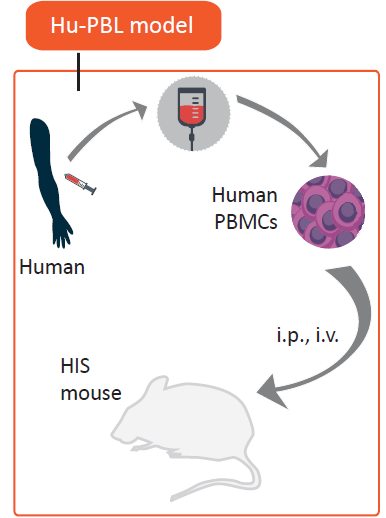
图1. Hu-PBMC模型的构建示意图。(图片来自Ref.2 )
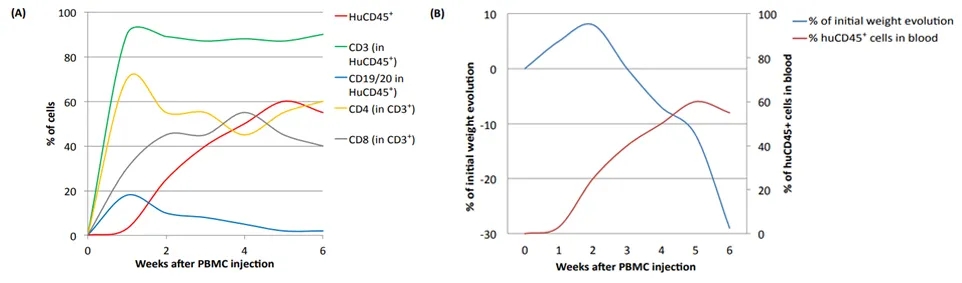
Hu-PBMC 模型的准备期较短。在移植PBMC后,最快一周就可以检测到人CD3+ T细胞;大约2周左右,免疫细胞就会快速重建;大约4周左右,小鼠外周血中可检测到约50%的人CD45+细胞,其中约90%为CD3+T细胞,CD4+: CD8+T细胞比率约为1:1。但是,Hu-PBMC模型会发生致死性的移植物抗宿主病(GvHD),程度与人T细胞的植入直接相关,可以通过小鼠体重的减轻来评估。一般移植后2-3周就会出现GvHD,因此实验观察窗较短。
图2. Hu-PBMC免疫系统人源化小鼠的免疫重建情况与GvHD发展。(A)人源化小鼠中静脉注射(i.v.)人外周血单核细胞(PBMC)后的重建。(B)人源化小鼠中注射PBMC后的造血重建和GvHD发展。PBMC注射后2至4周,血液中人CD45+细胞增加,同时小鼠发生GvHD,体重快速严重减轻。(Ref.2 )
另一类方法则是将人CD34+ HSCs注射到免疫缺陷宿主小鼠中,该方法需要首先对宿主小鼠进行亚致死剂量的辐照以消除小鼠HSC并促进人HSC的移植。此类模型也叫hu-CD34+ ,或叫 hu-SRC(scid-repopulatingcell)模型,已经被广泛应用于研究人类造血发育、细胞介导的免疫反应以及HIV和EBV等病毒感染性疾病中。
造血干细胞(Hematopoietic stem cell, HSC)是人体造血组织中能自我更新, 又能分化产生各系血细胞的一类细胞。CD34抗原是人们普遍认同的造血干/祖细胞的代表性表面标志, 它是一个高度糖基化的I型跨膜糖蛋白, 具有调节细胞粘附性的作用, 能促进细胞对骨髓基质的粘附。
通过静脉内(i.v.)或股骨内(i.f.)将来自人脐带血、骨髓、G-CSF激活的外周血或胎肝的人CD34+ HSCs注射到成年免疫缺陷小鼠中,可以产生多种造血干细胞,但T细胞产生量少,不具备功能性免疫细胞。或通过静脉注射(心内或肝内)将人CD34+HSCs移植到新生受体小鼠中(小于4周龄),得到良好的人细胞移植,并且产生T细胞、B细胞、巨噬细胞、NK细胞和DC细胞。胚胎肝脏和脐带血是最常用的人CD34+ HSCs来源,其较成年人HSCs更易定植于免疫缺陷小鼠。
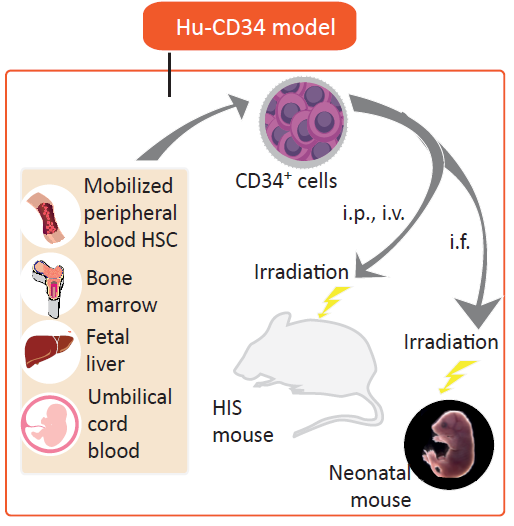
图3. Hu-HSC模型构建示意图。(图片来自Ref.2 )
目前认为Hu-HSC 模型是最适于研究免疫治疗的动物模型之一,其能建立人的固有免疫系统和淋巴细胞,通常不发生或轻微发生GvHD,可用于长期研究。不过也存在一定的局限性,例如,人T细胞在小鼠的胸腺内发育成熟,小鼠的主要组织相容性复合体(MHC)称为H2复合体,因此T细胞是小鼠H2限制性,而不表达人类白细胞抗原(HLA)。另外,由于人和小鼠之间的种属差异,小鼠体内缺乏人的细胞因子,人类干细胞在小鼠体内发育受限。
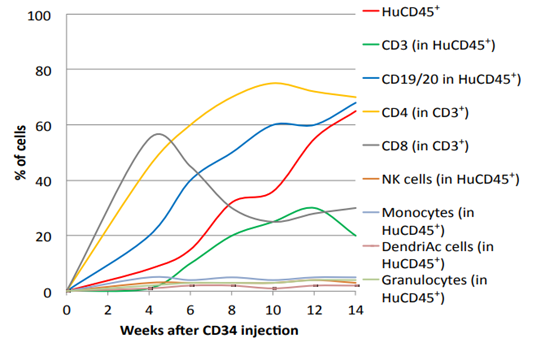
图4. HuCD34+ HSCs免疫系统人源化小鼠的免疫重建情况。(图片来自Ref.2 )
该模型是将免疫缺陷小鼠经亚致死剂量辐照处理后,将人胎肝和胸腺组织移植到成年免疫缺陷受体小鼠肾包膜下,同时将来自同一个体的胎肝或骨髓来源CD34+ HSCs 通过静脉注射(i.v.)给受体小鼠。
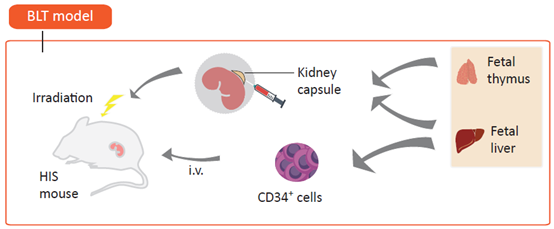
图5. Hu- BLT模型构建示意图。(图片来自Ref.2 )
移植的人胎肝和胸腺提供了人胸腺微环境,以支持人T细胞的发育分化,包含多种多样的HLA限制T细胞,可以建立有效的适应性免疫反应。因此,BLT 模型多用于适应性免疫反应的研究,如HIV感染。然而,BLT 模型的GvHD的发生率高于其他CD34+ HSC移植模型,也限制了该类模型的研究窗口。另外,由于操作上很难实现同一供者的肿瘤细胞和免疫系统相匹配,且Hu-BLT 模型建立过程中需要复杂精细的手术操作,也限制了Hu-BLT模型在肿瘤免疫药物研发中的应用。
我们可以用以下表格来大致归纳上述3种免疫系统人源化小鼠模型。
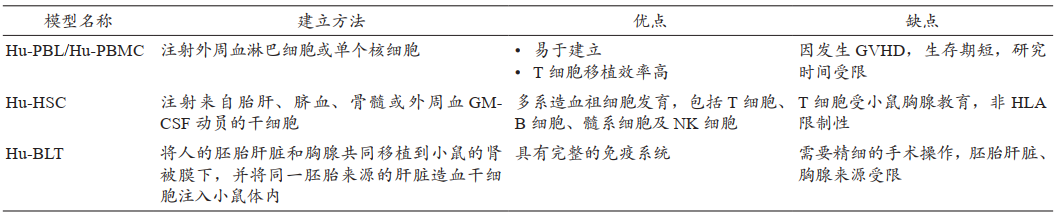
表2.不同免疫系统人源化小鼠模型的特点(表格来自Ref.3)
南模生物自主研发的Hu-PBMC和Hu-HSC模型
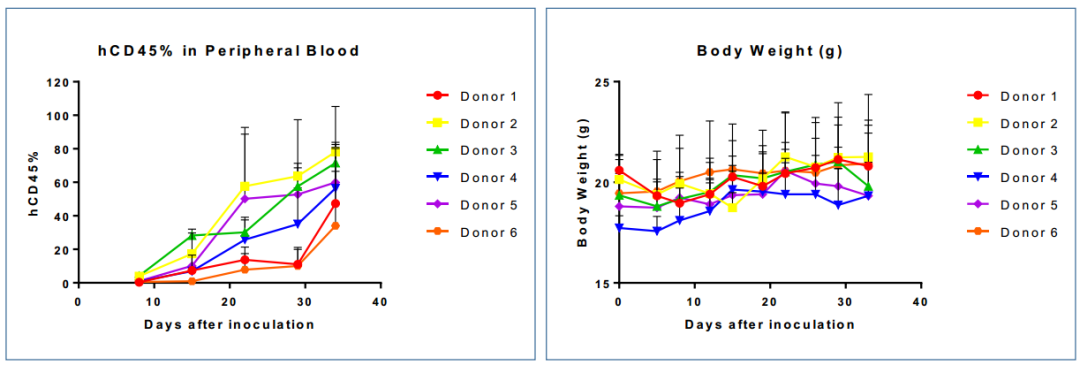
图6. 人源PBMC移植M-NSG小鼠后外周血中人源CD45+细胞的含量及小鼠体重变化。六个供体的PBMC分别经尾静脉注射入六组M-NSG小鼠体内,可检测到人源CD45+细胞比例总体趋势升高,其嵌合比例变化有差异,总体变化趋势符合预期。小鼠体重变化相对稳定。
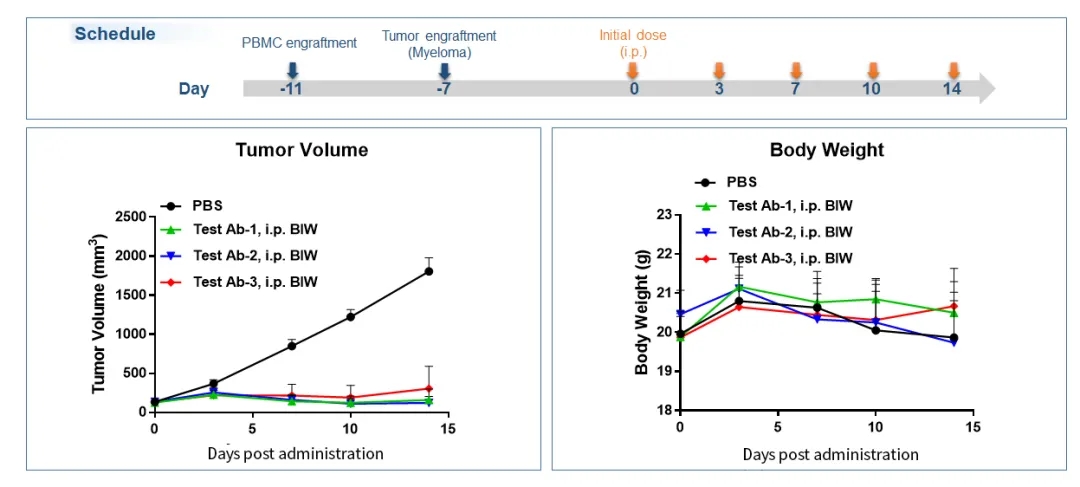
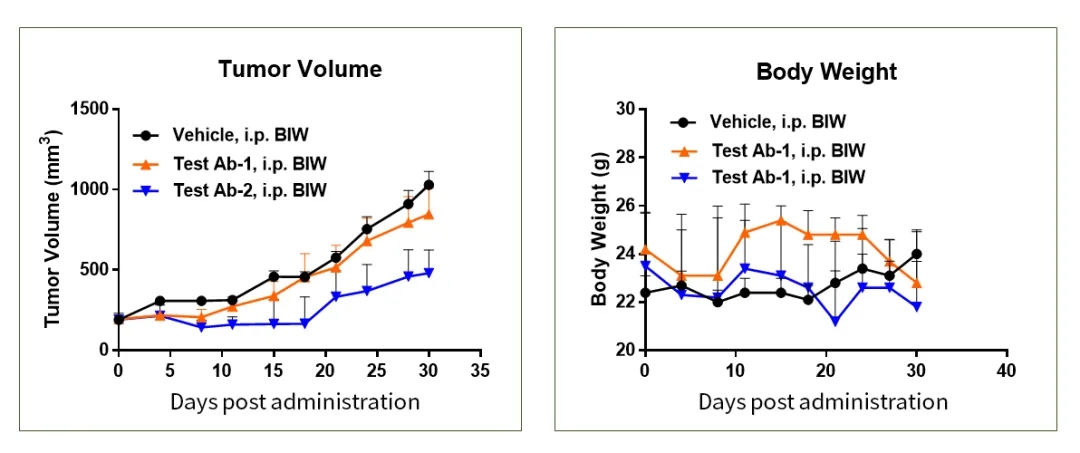
图7.Hu-PBMC荷瘤小鼠模型抗肿瘤药效验证示例1
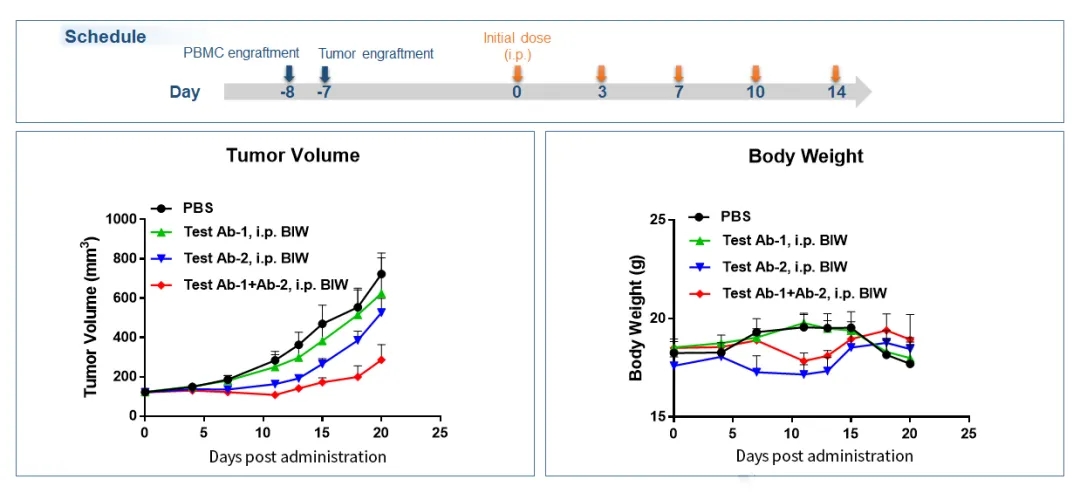
图8.Hu-PBMC荷瘤小鼠模型抗肿瘤药效验证示例2
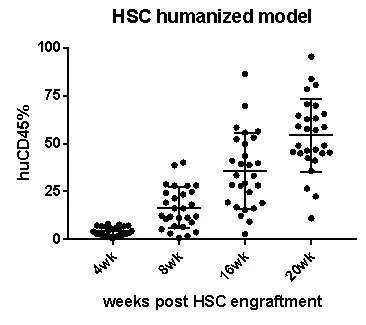
图9. 人造血干细胞(HSCs)移植M-NSG小鼠重建造血系统,人源CD45+免疫细胞在小鼠外周血水平不断升高。
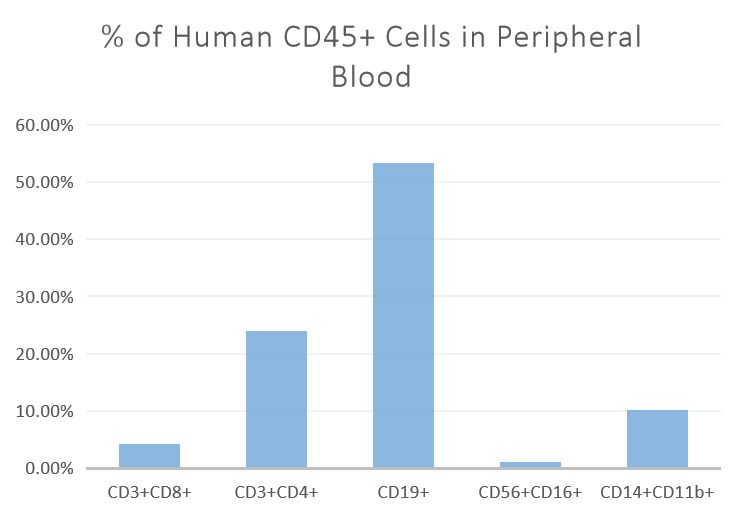
图10. 人造血干细胞(HSCs)移植入小鼠体内20周时各类造血/免疫细胞的比例,包括人源T(CD3+ CD4+和CD3+CD8+cells)、B(CD19+cells )、NK淋巴细胞(CD56+CD16+cells )及单核细胞(CD14+CD11b+cells)等。
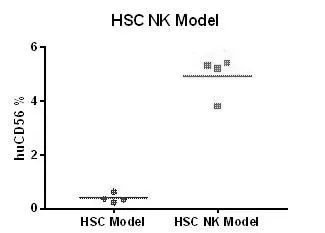
图11. 人造血干细胞(HSCs)移植M-NSG小鼠重建造血系统,并补充人源IL15,显著提升NK细胞比例,适合药物靶点在NK细胞上的药效评价。
Case1:
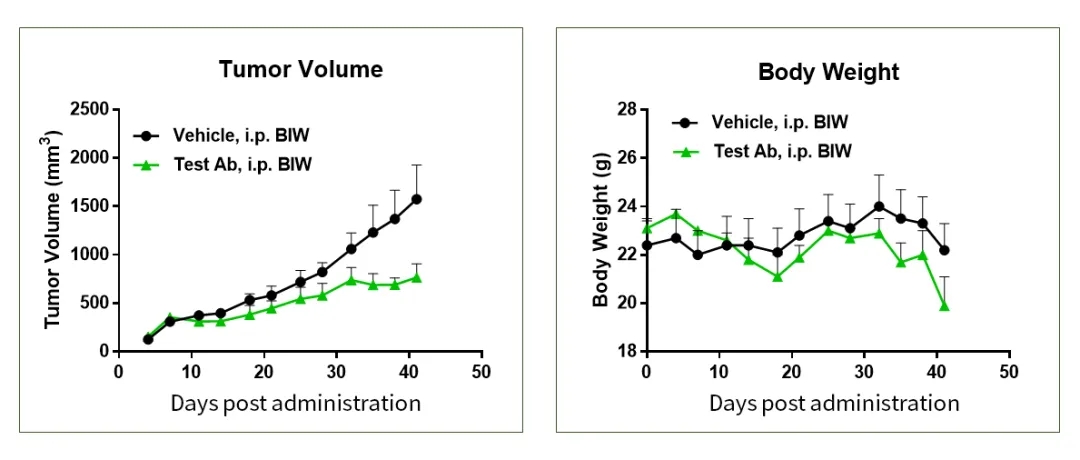
图12.Hu-HSC荷瘤小鼠模型抗肿瘤药效验证示例1
图13.Hu-HSC荷瘤小鼠模型抗肿瘤药效验证示例2
References
1.郑亚伟, 郝莎,胡林萍, 等. 免疫缺陷小鼠和人源化小鼠模型的发展及其在血液学研究中的应用. 中华血液学杂志,2015,36(11): 966-971.
2. De La Rochere P, Guil-Luna S, et al.Humanized Mice for the Study of Immuno-Oncology. Trends Immunol. 2018Sep;39(9):748-763.
3.李爽, 邹建玲, 鲁智豪, 沈琳. 免疫系统人源化小鼠模型的建立、应用及挑战. 中国医学前沿杂志(电子版), 2017, 9(10): 15-20.