科学家发现并确证肾癌治疗新靶点——SPOP
近年来肾癌发病率上升幅度在恶性肿瘤中排名第一。临床治疗表明,肾癌对放疗和化疗均不敏感,以 VEGFR 抑制剂索拉非尼和舒尼替尼为代表的靶向抗肿瘤药物是晚期肾癌的一线治疗药物。虽然 FDA 批准的针对肾癌治疗的药物已经多达十种,但这些药物均对转移性肾癌的疗效十分有限,并且容易产生耐药。因此,发现并确证治疗肾癌特异性药物作用新靶标是一项十分紧迫并意义重大的任务。
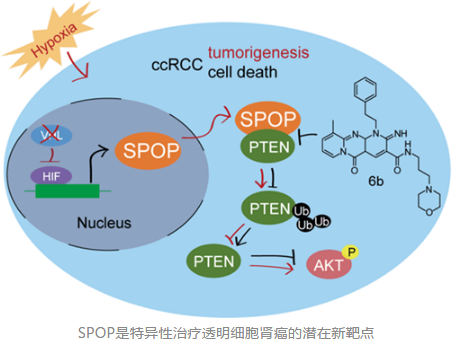
中科院北京基因组研究所的刘江研究员早期发现,泛素连接酶 E3 家族成员 Cul3 结合底物蛋白的接头蛋白 SPOP 在 99% 的透明细胞肾癌的肿瘤组织中过表达,而在正常肾组织中表达很低,并且转移性透明细胞肾癌中 SPOP 仍然过表达,表明 SPOP 是透明细胞肾癌的生物标志分子(Science, 2009, 323, 1218-1222)。刘江课题组进一步研究发现,SPOP 在透明细胞肾癌组织中错误定位在细胞质里。过度活化的缺氧诱导因子 HIF 转录增强 SPOP 过表达,并且低氧微环境驱使过表达的 SPOP 蛋白在肾癌细胞质中大量累积,最终促进肾癌形成(Cancer Cell, 2014, 25, 455-468)。
上述生物学基础研究提出一个关键科学问题,小分子化合物是否可以靶向性干扰 SPOP 介导的蛋白质相互作用,实现特异性治疗透明细胞肾癌?中科院上海药物研究所杨财广课题组、蒋华良课题组与刘江课题组合作,以 SPOP 与蛋白质相互作用为靶标,根据 SPOP 识别底物多肽复合物晶体结构的特点,综合应用基于结构的筛选策略、药物化学合成优化等技术手段,成功获得能够与 SPOP 结合的小分子化合物。该化合物能抑制 SPOP 与底物蛋白质的结合,干预 SPOP 介导的调控 PTEN、DUSP7 等抑癌蛋白的泛素化修饰的信号转导通路,最终有效抑制透明细胞肾癌细胞在体内外的生长。这一重要成果发表在《Cancer Cell》上。该项研究为 SPOP 能否作为透明细胞肾癌药物靶标进行了药理功能确证,同时为 SPOP 抑制剂的发现并运用于治疗肾癌指明了不同于激酶抑制剂的新方向。几乎与此同时,《Nature》杂志上也连发两文,报道了关于缺氧诱导因子 HIF-2α抑制剂 PT2399 的相关研究结果(其类似物 PT2385 已经进入临床一期),预示针对 HIF 通路的小分子抑制剂也将可能成为肾癌治疗的新靶标。
本研究由上海药物所与北京基因组所合作完成,同时得到了北京大学第一医院、武汉大学中南医院、北京师范大学、兰州大学等课题组的共同支持。研究还得到了国家自然科学基金委、科技部、中科院等有关项目的资助。