暨南大学陈填烽课题组发现用于肿瘤同步放化疗的纳米药物
热门推荐: 6月15-17上海-2017第一届DNA甲基化与疾病精准诊治:机遇和挑战国际研讨会
近日,暨南大学化学与材料学院陈填烽教授和中国科学院深圳先进技术研究院喻学锋研究员合作,在靶向纳米载药体系研究中取得重要进展,设计合成了一种核壳结构的靶向纳米复合体系,从而实现了肿瘤靶向的放化疗法。
此项研究成果发表在纳米领域顶级期刊 ACS Nano(IF =13.334)上,研究工作得到了中组部万人计划青年拔尖人才项目、国家高技术研究发展计划 (863 计划) 项目、国家自然科学基金及广东省自然科学杰出青年基金等项目的资助。
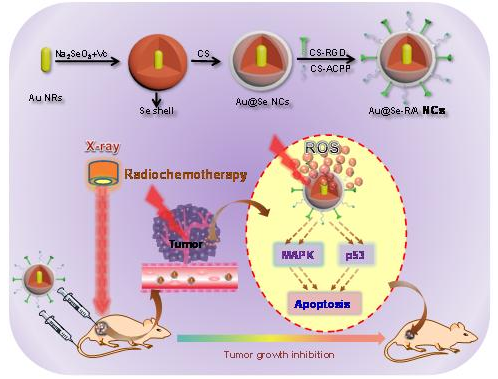
陈填烽课题组在前期工作中,以多种蛋白、多糖、多肽及小分子作为修饰剂,合成了多个系列不同形貌的纳米硒(SeNPs),并用其为载体来负载临床用的抗肿瘤药物,发现可实现良好的协同化疗增敏的效果。在此基础上,该团队通过整合 Au NRs 的放射增敏特性和 SeNPs 的抗肿瘤活性,设计合成了核壳结构的 Au@Se 纳米复合体系(NCs),并进行双靶向分子表面修饰,实现肿瘤靶向的同步放化疗法。该纳米复合体系表现出优越的肿瘤靶向能力、良好的生物安全性、高效的放射增敏作用和显著的体内抗肿瘤效果。进一步的机理研究表明,NCs 和 X -ray 联合应用是通过死亡受体途径诱导肿瘤细胞凋亡并促进 ROS 过量产生从而激活下游 ROS 介导的信号通路,导致大大提高抗肿瘤活性。这项研究为肿瘤靶向的放化疗法提供了一种有效的临床可行的技术。
目前,放疗和化疗是临床上肿瘤最常用的治疗方法,但其疗效受到射线辐射剂量和药物毒性的极大限制。因此,开发高效低毒的放化疗增敏剂具有重大意义。近年来,大量的无机金属纳米粒子被应用于放疗增敏。其中,金纳米粒子 (AuNPs) 因其独特的光学性质、良好的组织相容性、易控的表面修饰性等使其在生物及医学领域有了广阔应用前景。硒是人体必需的重要微量元素,以硒为原料来设计纳米体系,既能发挥硒的生物学功能,同时又兼具纳米载体的载药与协同功能。
陈填烽课题组一直致力于靶向纳米药物的化学设计及其在肿瘤诊疗中的应用及机理研究,相继在 AngewChemInt Edit、ACS Nano、 Advanced Functional Materials、 Biomaterials 等本领域重要期刊上发表研究论文超过 30 篇。其中,15 篇论文被 Advanced Functional Materialsc 及 Journal of Materials Chemistry B 等杂志当做封面文章发表。
相关会议推荐: 第一届DNA甲基化与疾病精准诊治:机遇和挑战国际研讨会 6月15-17 上海