重磅!伦敦癌症研究中心科学家找到食管癌的软肋,有望拯救近半数的食管癌患者
8 月 22 日,来自伦敦癌症研究所 Christopher Lord 教授的科研团队在胃肠病领域顶级期刊《Gut》杂志上刊登了一项关于食管癌治疗的突破性发现(1),他们可能找到了食管癌的软肋。
他们发现,靶向 Bruton 酪氨酸激酶(BTK)同时,研究人员还发现,目前 FDA 已经批准的用于治疗多种癌症的 BTK 抑制剂 ibrutinib,同样可以显著抑制食管癌细胞的增殖,并且与小分子干扰 RNA 活性相当。
由于近半数的食管癌患者体内都会出现 MYC/ERBB2 基因活性上调(2)。这意味着,近半数的食管癌患者将有望从这一发现中受益。

Lord 教授
食管癌是一种在发展中国家属常见肿瘤,我国更是食管癌发生大国。2014 年世界卫生组织的统计资料显示,我国食管癌患者人数已经占到了全球患者的一半,同时,全球近 45 万死亡病例中,有 49% 发生在我国(3)。特别地,河南、四川、福建和广东等都是我国食管癌高发地区,河南安阳、河北邯郸以及晋东南地区食管癌死亡率常年居高不下。
而由于食管癌侵袭性特别强,大多数患者确诊时就已经是中、晚期了,无法进行手术治疗。而就算有小部分患者可以进行手术治疗,食管癌术后的复发率也非常高。此外,除了手术之外,食管癌目前可用的临床治疗方案非常有限。因此,食管癌患者总体的 5 年生存率只有 19%(4)。
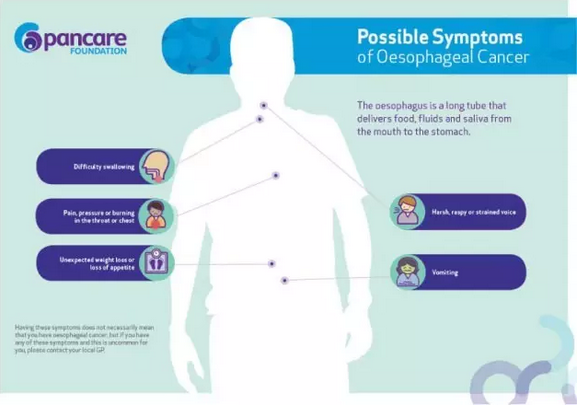
食管癌常见的临床症状
食管癌可以分为食管腺癌(EAC)以及食管鳞癌(ESCC)两大类。目前对于 EAC 的治疗有基于顺铂,紫杉烷类,喜树碱类的化疗。同时,化疗无效的 EAC 患者还有一些靶向药物可以选择,例如靶向抗血管内皮生长因子受体的 ramucirumab,尽管这些治疗方案的效果并不是很好(5)。
而对于 ESCC,除了化疗之外目前还没有靶向药物被批准用于 ESCC 的治疗。也就是说,一旦一线化疗方案失败,将没有任何治疗方案可供 ESCC 患者选择。但是,偏偏 90% 的食管癌患者都属于 ESCC(3)。因此,寻找食管癌治疗新方案是非常必要的,尤其对那些无药可用的 ESCC 患者。
Lord 教授长期致力于食管癌的研究。而为了找到合适的治疗食管癌的药物,Lord 教授的想法非常“简单粗暴”。既然,癌细胞是由基因突变产生的,同时,癌细胞的生长增殖往往很依赖于某些活性上调的基因,即促癌基因,而正常的细胞不会。那么,这些癌细胞所依赖的基因,以及其控制的下游通路同时也是治疗癌症很有希望的靶点。
而为了找到这些潜在的靶点,Lord 教授的做法更加“简单粗暴”。首先,Lord 教授选择了 17 种常见的食管癌细胞系(包括 8 中 EAC 细胞系以及 9 种 ESCC 细胞系)进行实验。收集了这 17 种常见的食管癌细胞的基因数据,并按癌细胞内促癌基因的类型进一步将这些细胞分类。例如,MYC 基因活性上调的癌细胞归为一类。
随后,Lord 教授直接用 80 种临床上常用的或者处于研发后期的抗癌药物来处理这些细胞(这些药物的作用靶点是完全不同的),以收集不同类型的食管癌细胞对于这些药物的敏感性数据。同时,Lord 教授还找到了 714 种已知的靶向与癌症相关激酶的小分子干扰 RNA(6),同样用这些小分子干扰 RNA 处理所有不同类型的细胞,以收集癌细胞对这些激酶调控的基因的依赖性数据。
通过整合这些数据 Lord 教授发现,常见的促癌基因 MYC 活性上调的食管癌细胞对于靶向布 BTK 的小分子干扰 RNA 异常敏感。靶向 BTK 的小分子干扰 RNA 可以显著抑制 MYC 基因活性上调癌细胞的生长增殖。
由于 FDA 已经批准 BTK 抑制剂 ibrutinib 用于多种的癌症治疗(7,8),同时,已知 ibrutinib 还能直接抑制促癌基因 ERBB2 的活性(9)。因此 Lord 教授便同时测试了 ibrutinib 对于 MYC 以及 ERBB2 基因活性上调的食管癌细胞的效果。
结果,Lord 教授惊喜的发现,ibrutinib 与靶向 BTK 的小分子干扰 RNA 效果相似,同样可以显著抑制 MYC 基因活性上调食管癌细胞的生长增殖。不仅如此,对于 ERBB2 基因上调的食管癌细胞,ibrutinib 同样有效。
最后,研究人员还发现了 ibrutinib 抑制 MYC 或者 ERBB2 基因上调癌细胞的机制。ibrutinib 可以选择性诱导 MYC 以及 ERBB2 基因活性上调的癌细胞在有丝分裂时,停止在 G1 期,随后引发癌细胞凋亡,从而发挥抗癌作用。
由于 ibrutinib 此前已经被 FDA 批准用于其他类型癌症的治疗。所以 ibrutinib 的安全剂量范围是已知的。因此,Lord 教授已经开始进行二期临床试验,进一步验证 ibrutinib 对于 MYC 以及 ERBB2 基因活性上调患者的有效性。
同时,此前的研究表明,ERBB2 基因在 11% 的 ESCC 患者以及 32% 的 EAC 患者中活性显著上调。而 MYC 基因活性同样在 23% 的 EAC 患者以及 32% 的 ESCC 患者体内上调(2)。这意味着,一旦 ibrutinib 在人体实验中被证明有效,那么近半数的食管癌患者将会从中受益。
总的来说,这一发现无疑是非常重要的。此前研究表明,无论是化疗还是仅有的针对 EAC 的靶向治疗,患者的无进展生存期都在 7 个月左右(10)。因此,大部分患者在治疗过程中会经历癌症的复发。而此时,占比 90% 的 ESCC 患者已经无药可用。这也可能是食管癌 5 年生存率如此低的一个重要原因。我们也期待 ibrutinib 能在针对食管癌的二期临床中取得良好效果。
参考资料:
1.http://dx.doi.org/10.1136/gutjnl-2017-314408
2.Cancer Genome Atlas Research Network. Integrated genomic characterization of oesophageal carcinoma[J]. Nature, 2017, 541(7636): 169-175.
3.World Cancer Report 2014[M]. World Health Organization, 2014.
4.Rustgi A K, El-Serag H B. Esophageal carcinoma[J]. New England Journal of Medicine, 2014, 371(26): 2499-2509.
5.Pozzo C, Barone C, Szanto J, et al. Irinotecan in combination with 5-fluorouracil and folinic acid or with cisplatin in patients with advanced gastric or esophageal-gastric junction adenocarcinoma: results of a randomized phase II study[J]. Annals of Oncology, 2004, 15(12): 1773-1781.
6.Campbell J, Ryan C J, Brough R, et al. Large-scale profiling of kinase dependencies in cancer cell lines[J]. Cell reports, 2016, 14(10): 2490-2501.
7.Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013;369:32–42.
8.Wang ML, Rule S, Martin P, et al. Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma. N Engl J Med 2013;369:507–16.
9.Grabinski N, Ewald F. Ibrutinib (ImbruvicaTM) potently inhibits ErbB receptor phosphorylation and cell viability of ErbB2-positive breast cancer cells. Invest New Drugs 2014;32:1096–104.
10.Bang Y J, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. The Lancet, 2010, 376(9742): 687-697.