发现肿瘤治疗新策略 暨南大学药学院团队在 JCI 发表高水平研究成果
2017 年 8 月 28 日,暨南大学药学院团队在国际著名学术期刊《临床研究杂志》(The Journal of Clinical Investigation,影响因子 12.78)在线全文发表了题为“Pericyte-targeting prodrug overcomes tumor resistance to vascular disrupting agents”的研究论文,首次报道了 FAPα酶激活式长春碱类前药 Z -GP-DAVLBH 通过靶向肿瘤周细胞选择性破坏肿瘤血管,从而抑制多种恶性肿瘤和阻止肿瘤的转移作用及其机制。叶文才教授、张冬梅教授和陈河如教授为该论文的共同通讯作者;陈敏锋博士和雷雪萍博士为共同第一作者;第一附属医院罗良平教授、南方医科大学马安德教授、广州医科大学李洪胜教授等合作开展了此项研究工作。
肿瘤血管为肿瘤组织输送氧气和养分,在肿瘤的发生、发展过程中扮演着十分重要的角色,因此,靶向肿瘤血管是一种有效的肿瘤治疗方案。血管破坏剂通过损伤肿瘤血管内皮细胞从而特异性地破坏肿瘤血管,在临床试验中发挥了良好的抗肿瘤疗效。然而,由于血管破坏剂不能破坏肿瘤边缘组织的血管,因此血管破坏剂治疗后会在肿瘤边缘组织残留明显的“生存圈”,导致肿瘤的复发和转移。多年来人们一直尝试将血管破坏剂和放、化疗药物联合用药等方法来消除生存圈,但临床效果一直不理想。因此,发现一种既可破坏肿瘤血管也可抑制生存圈的治疗方法,无疑具有重大的临床应用价值。
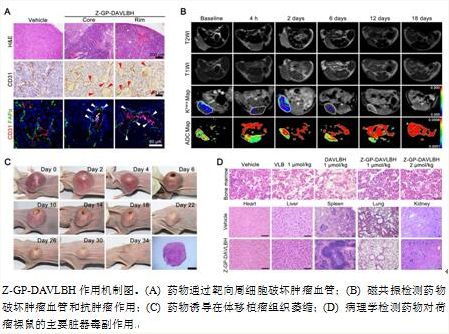
该团队经过五年多的探索,发现肿瘤边缘组织的血管周细胞覆盖率较高,并创造性地提出靶向肿瘤血管周细胞来破坏肿瘤血管和生成圈这一设想。为了靶向肿瘤血管周细胞,该团队利用 FAPα酶选择性高表达于肿瘤血管周细胞的这一特性,以长春碱衍生物 DAVLBH 设计并合成了 FAPα酶激活式长春碱前药 Z -GP-DAVLBH。该前药可特异性被肿瘤血管周细胞表达的 FAPα酶水解,从而诱导肿瘤血管周细胞收缩、脱落,引起肿瘤中心及边缘的血管破裂,导致整个肿瘤组织缺血缺氧而坏死。该研究首次阐明了靶向肿瘤周细胞是一种既可破坏肿瘤血管,又可有效克服肿瘤治疗耐受的全新治疗策略。
作为第一个靶向周细胞的肿瘤血管破坏剂类候选药物,Z-GP-DAVLBH 除了可诱导乳腺癌、肺癌、肝癌、宫颈癌和鼻咽癌裸鼠皮下移植瘤模型萎缩和消失外,还可诱导乳腺癌肺转移病灶的坏死和消失。另外,Z-GP-DAVLBH 在治疗剂量下对荷瘤裸鼠的毒副作用比长春碱低,对外周血白细胞计数影响较小,对心、肝、脾、肺、肾和骨髓等脏器组织无明显损伤,提示其具有良好的成药性,具广泛的应用前景。
该项研究成果已申请中国发明专利 4 项、国际 PCT 专利 1 项,PCT 专利已进入美国、欧盟、日本、澳大利亚和印度等国家。目前,该团队正在进行新药申报的临床前研究,预计 2019 年申报临床研究批件。
论文链接:https://www.jci.org/articles/view/94258