干货速递 | 带你了解新抗原的来源
前言
相较于肿瘤相关性抗原(tumor associated antigen,TAA),肿瘤特异性抗原(tumor specific antigen,TSA)仅在肿瘤细胞中表达,正常细胞不表达,避免了免疫系统对自身细胞的误击,具有更强的特异性和安全性。新抗原同样属于肿瘤特异性抗原,可通过多种机制从肿瘤中产生,如基因组突变、异常转录组变体、翻译后修饰(PTMs)以及病毒开放阅读框(ORF)。
细胞基因组的改变,包括单核苷酸变异(SNV)、碱基插入和缺失(INDEL)以及基因融合,是促使肿瘤新抗原产生的主要因素。
1. 单核苷酸位点变异(SNVs)
含义:SNV 是肿瘤细胞基因组水平上最为常见的突变类型,每位癌症患者可有多达数百个非同义体细胞突变,平均每人可产生 150 个潜在的新抗原肽。
特点:
临床研究:利用癌症基因组图谱(TCGA)数据库对 20 例实体肿瘤中表达的新抗原进行特征分析,这些新抗原中仅有 24 种为相同或不同癌症患者所共享。
2. 基因插入和删除(INDELs)
含义:INDEL 突变主要由基因组中碱基对的插入或缺失引起,常导致非同义的新开放阅读框(ORF),也称为移码突变。
特点:亲和力强:与 SNV 相比,INDEL 突变能够产生更多与 MHC-I 结合力更强的新抗原。
相关癌症:由于缺乏 DNA 错配修复(MMR)机制,INDEL 新抗原在微卫星不稳定性高(MSI-H)的癌症中更为普遍,如在 MMR 缺陷型癌症(如子宫内膜癌、结直肠癌和胃癌)中较为常见。
临床研究:
3. 基因融合
含义:基因融合可由间充质缺失、染色体易位或染色体倒位产生。
特点:
临床研究:
4. 结构变体(如染色体重排)
含义:结构变体(SVs)通常指大于 50 个碱基对的遗传变异,如插入、缺失、反转、易位、重复 / 扩增、染色体添加和缺失,以及染色体重排。其中,染色体重排最为复杂,是肿瘤的一个突出特征,在各种恶性肿瘤的发生和免疫识别中起着至关重要的作用。
含义:由于 RNA 顺式调节元件、反式作用调节因子或核心剪接体的突变导致的异常 mRNA 剪接。
1.1 顺式作用突变(cis-acting mutation)
含义:顺式作用元件又称分子内作用元件,指存在于 DNA 分子上的一些与基因转录调控有关的特殊顺序,如启动子、增强子、调控序列等。顺式作用元件的突变通过改变剪接产生潜在的新抗原,包括可变的 3’端、可变的 5’端、内含子保留、外显子跳跃和外显子互斥。
特点:
临床研究:
1.2 剪接因子的反式作用改变 (Trans-acting alterations)
含义:即剪接因子的体细胞突变导致剪接变异体的改变,诱导新抗原的产生。
临床研究:
1.3 无义介导的 RNA 衰变(NMD)
含义:是一种高度保守的 RNA 周转机制,优先破坏携带提前终止密码子的 RNA,避免产生异常蛋白质。
来源:
临床研究:NMD 经常降解编码新抗原肽的 mRNA。因此,NMD 抑制疗法可能有益于治疗各种癌症,包括那些能够产生大量突变新抗原的癌症。
2. 多腺苷酸化(pA)与 RNA 编辑
含义:在真核生物中,多聚腺苷酸化(Polyadenylation)是一种机制,令 mRNA 分子于它们的 3' 端中断。RNA 编辑是一种重要的 mRNA 前处理方法,可以通过改变 RNA 序列中的特定核苷酸来诱导非同义替换,从而产生新的蛋白质。
临床研究:腺苷 - 肌苷(A-to-I)编辑是哺乳动物中最常见的 RNA 编辑类型,在人类基因中发现了数百万个这样的位点。A-to-I 编辑产生的蛋白质肽可以由 MHC-I 分子呈递,MHC-I 进一步诱导特异性 CD8+T 细胞的激活,这表明这些新肽具有免疫原性,可以激活免疫系统。然而,这些肽不一定是肿瘤特异性的,因为 RNA 编辑也可以发生在正常组织中。
3. 非编码区域
含义:鉴于 99% 的肿瘤特异性突变发生在基因的非编码区,而外显子区仅占整个人类基因组的 2%,仅来源于外显子区域突变新抗原的筛选是有限的。最近的研究表明,许多以前被定义为非编码的区域现在被发现具有编码功能。通过研究这些新定义的具有编码能力的基因,研究人员发现了许多新的 MHC-I 可以呈递的抗原肽,并且一些抗原已被证实为 TIL 免疫疗法的靶点。
临床研究:最近,使用质谱(MS)方法,已经鉴定出许多种类的非编码区产生大量异常表达的肿瘤特异性抗原,其中大部分来源于非典型翻译事件中的表观遗传学修饰,而不是突变。这些异常表达的肿瘤特异性新抗原比编码区突变产生的新抗原更普遍,并且可以在肿瘤患者之间共享。与其它突变相比,来自非编码区翻译的新抗原很少被深入研究和理解。因此,迫切需要开发快速高效的计算算法来筛选这些潜在的新抗原,并验证其用于免疫治疗的可行性。
含义:蛋白质组变体来自于翻译失调、PTMs、蛋白酶体加工和与抗原加工相关的转运蛋白(TAP)的异常功能。
来源:
临床研究:
四、病毒来源的肿瘤抗原(病毒 ORFs)
含义:病毒蛋白可以被认为是病毒引起的肿瘤中的另一类新抗原,因为它们几乎完全不同于正常细胞蛋白,并且它们可以引发高亲和力的 TCR 反应。例如,HPV 中 E6 和 E7 基因的表达促进了人乳头瘤病毒(HPV)相关宫颈癌、肛门癌、头颈癌的发展和进展。
临床研究:
值得注意的是,这些临床试验都没有对正常组织产生任何明显的毒性。这些试验证明了靶向致癌病毒蛋白治疗相关肿瘤的安全性和有效性,并且它们在肿瘤发生中是患者共享的,因此病毒衍生的新抗原仍然是癌症免疫治疗的理想靶点。
小结
新抗原是由于基因组、转录组和蛋白质组水平的改变而产生的。目前的研究主要集中在 SNVs 和 INDEL,这是肿瘤细胞基因组水平上最常见的突变类型。然而,SNVs 和 INDEL 产生的新抗原由于患者特异性和免疫原性差而限制了其临床应用,这导致癌症患者的临床受益较少。越来越多的证据表明,癌症新抗原的替代来源,如基因融合、剪接变异体和 PTM,可能是吸引人的免疫治疗新靶点。通过基因融合产生的新抗原,比 SNVs 和 INDEL 新抗原具有更好的免疫原性,后者已被纳入许多临床试验。此外,基因融合产生的新抗原、癌症驱动基因的复发突变、非编码区和异常 PTM 在患者之间共享的可能性更高,为免疫治疗提供了容易公用的新抗原。
相较于肿瘤相关性抗原(tumor associated antigen,TAA),肿瘤特异性抗原(tumor specific antigen,TSA)仅在肿瘤细胞中表达,正常细胞不表达,避免了免疫系统对自身细胞的误击,具有更强的特异性和安全性。新抗原同样属于肿瘤特异性抗原,可通过多种机制从肿瘤中产生,如基因组突变、异常转录组变体、翻译后修饰(PTMs)以及病毒开放阅读框(ORF)。
一、基因组变异体
细胞基因组的改变,包括单核苷酸变异(SNV)、碱基插入和缺失(INDEL)以及基因融合,是促使肿瘤新抗原产生的主要因素。
1. 单核苷酸位点变异(SNVs)
含义:SNV 是肿瘤细胞基因组水平上最为常见的突变类型,每位癌症患者可有多达数百个非同义体细胞突变,平均每人可产生 150 个潜在的新抗原肽。
特点:
- 差异显著:不同癌症类型以及相同癌症类型的不同阶段之间,SNV 新抗原的分布差异很大。
- 可存在于线粒体 DNA(mtDNA):线粒体 DNA 存在于大多数癌症细胞中,与肿瘤代谢谱以及癌症细胞转移能力的改变相关。mtDNA 中的非同义 SNPs 可能会产生大量的突变肽,提供了新抗原的额外来源。
临床研究:利用癌症基因组图谱(TCGA)数据库对 20 例实体肿瘤中表达的新抗原进行特征分析,这些新抗原中仅有 24 种为相同或不同癌症患者所共享。
2. 基因插入和删除(INDELs)
含义:INDEL 突变主要由基因组中碱基对的插入或缺失引起,常导致非同义的新开放阅读框(ORF),也称为移码突变。
特点:亲和力强:与 SNV 相比,INDEL 突变能够产生更多与 MHC-I 结合力更强的新抗原。
相关癌症:由于缺乏 DNA 错配修复(MMR)机制,INDEL 新抗原在微卫星不稳定性高(MSI-H)的癌症中更为普遍,如在 MMR 缺陷型癌症(如子宫内膜癌、结直肠癌和胃癌)中较为常见。
临床研究:
- 在具有中等肿瘤突变负荷的肾细胞癌中,21% 的 T 细胞识别的新表位来自于移码 INDEL,这表明移码突变产生的新表位具有更大的免疫原性。
- 根据一项 I 期 / II 临床试验,移码肽新抗原疫苗具有良好的系统耐受性,并能定期触发免疫反应,为治疗和预防 MMR 缺陷型恶性肿瘤提供了一种有前景的新策略。
- INDEL 新抗原也是免疫检查点阻断(ICB)反应的新生物标志物。INDEL 突变被认为会产生更多免疫原性新抗原,从而提高对 ICB 的反应。当出现移码突变时,接受 ICB 的患者无进展生存期显著延长。
3. 基因融合
含义:基因融合可由间充质缺失、染色体易位或染色体倒位产生。
特点:
- 具有更高的免疫原性:融合突变能够产生更多新的 ORF,比 SNV 和 INDEL 多产生 6 倍的新抗原和 11 倍的特异性候选新抗原。融合新抗原比 SNV 和 INDEL 产生的新抗原更可能诱导更强的免疫应答,并且移码融合产生的新抗原比框内融合新抗原具有更好的免疫原性。
- 重复率低:不同患者之间融合新抗原的重复率极低。据统计,TCGA 数据库中仅有 5.8% 的融合新抗原在患者之间重复,这些新抗原通常具有非常低的免疫原性。
临床研究:
- 研究表明,源自蛋白质不同融合区的多肽可被患者自身的 T 细胞识别,例如由慢性髓性白血病(CML)患者的染色体 9 和 22 之间的易位产生的 BCR-ABL 融合蛋白以及由滑膜肉瘤患者的 X 和 18 染色体易位产生的 SYT-SSX1 融合蛋白。即使在一些 TMB 低且免疫浸润有限的肿瘤中,基因融合产生的新抗原仍然能够激活细胞毒性 T 细胞。
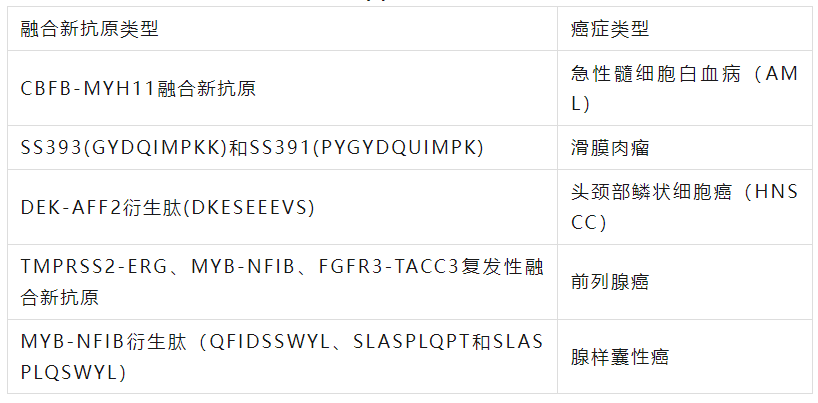
- 基因融合衍生的新抗原可以引发针对肿瘤的特异性免疫反应。下表罗列了临床研究证明具有免疫应答的融合新抗原及对应的癌症类型。
4. 结构变体(如染色体重排)
含义:结构变体(SVs)通常指大于 50 个碱基对的遗传变异,如插入、缺失、反转、易位、重复 / 扩增、染色体添加和缺失,以及染色体重排。其中,染色体重排最为复杂,是肿瘤的一个突出特征,在各种恶性肿瘤的发生和免疫识别中起着至关重要的作用。
二、转录组变体
1. 转录物选择性剪接含义:由于 RNA 顺式调节元件、反式作用调节因子或核心剪接体的突变导致的异常 mRNA 剪接。
1.1 顺式作用突变(cis-acting mutation)
含义:顺式作用元件又称分子内作用元件,指存在于 DNA 分子上的一些与基因转录调控有关的特殊顺序,如启动子、增强子、调控序列等。顺式作用元件的突变通过改变剪接产生潜在的新抗原,包括可变的 3’端、可变的 5’端、内含子保留、外显子跳跃和外显子互斥。
特点:
- 与正常对照组织相比,内含子保留在癌症组织中更普遍。
- 与 SNV 突变产生的突变相比,外显子跳跃产生的新抗原发生频率更高,更有可能在患者之间共享。
临床研究:
- 最近的一项研究已将非经典剪接机制外内含子(exitron)剪接确定为肿瘤新抗原的新来源。外内含子是隐蔽的内含子,它的两个剪接位点都在注释已知的外显子内。外内含子位于外显子的内部区域,同时具有蛋白编码(外显子)和剪接(内含子)的潜力。
- 由于肿瘤特异性外显子剪接转录物比内含子保留更容易逃离无义介导的 RNA 衰变(NMD),因此它们的总体表达高于保留的内含子。因此,在 TMB 较低的恶性肿瘤中,外显子剪接产生了更有效的新抗原,具有更高的免疫原性。
1.2 剪接因子的反式作用改变 (Trans-acting alterations)
含义:即剪接因子的体细胞突变导致剪接变异体的改变,诱导新抗原的产生。
临床研究:
- 在血液系统恶性肿瘤中,剪接体成分的常见突变,包括 SRSF2、SF3B1 和 U2AF1/2,提高了剪接变异体 mRNA 的表达,导致 TSA 和新抗原的翻译。
- 除血液肿瘤外,最近对 TCGA 数据库中泛癌数据的重新评估表明,剪接因子的体细胞改变,包括 SF3B1、U2AF1、SRSF2 和锌指 CCCH 型、ZRSR2、U2AF2、SF1、PRPF8 和 SF3A1,导致在实体肿瘤基因组中产生剪接变异衍生新抗原。
1.3 无义介导的 RNA 衰变(NMD)
含义:是一种高度保守的 RNA 周转机制,优先破坏携带提前终止密码子的 RNA,避免产生异常蛋白质。
来源:
- 在 NMD 功能正常的细胞中,启动 NMD 介导的异常转录物降解需要一轮翻译,这可能导致少量新抗原的产生。
- NMD 调节机制在肿瘤细胞中经常受损,使得异常转录物能够避免降解并潜在地产生大量新抗原。
临床研究:NMD 经常降解编码新抗原肽的 mRNA。因此,NMD 抑制疗法可能有益于治疗各种癌症,包括那些能够产生大量突变新抗原的癌症。
2. 多腺苷酸化(pA)与 RNA 编辑
含义:在真核生物中,多聚腺苷酸化(Polyadenylation)是一种机制,令 mRNA 分子于它们的 3' 端中断。RNA 编辑是一种重要的 mRNA 前处理方法,可以通过改变 RNA 序列中的特定核苷酸来诱导非同义替换,从而产生新的蛋白质。
临床研究:腺苷 - 肌苷(A-to-I)编辑是哺乳动物中最常见的 RNA 编辑类型,在人类基因中发现了数百万个这样的位点。A-to-I 编辑产生的蛋白质肽可以由 MHC-I 分子呈递,MHC-I 进一步诱导特异性 CD8+T 细胞的激活,这表明这些新肽具有免疫原性,可以激活免疫系统。然而,这些肽不一定是肿瘤特异性的,因为 RNA 编辑也可以发生在正常组织中。
3. 非编码区域
含义:鉴于 99% 的肿瘤特异性突变发生在基因的非编码区,而外显子区仅占整个人类基因组的 2%,仅来源于外显子区域突变新抗原的筛选是有限的。最近的研究表明,许多以前被定义为非编码的区域现在被发现具有编码功能。通过研究这些新定义的具有编码能力的基因,研究人员发现了许多新的 MHC-I 可以呈递的抗原肽,并且一些抗原已被证实为 TIL 免疫疗法的靶点。
临床研究:最近,使用质谱(MS)方法,已经鉴定出许多种类的非编码区产生大量异常表达的肿瘤特异性抗原,其中大部分来源于非典型翻译事件中的表观遗传学修饰,而不是突变。这些异常表达的肿瘤特异性新抗原比编码区突变产生的新抗原更普遍,并且可以在肿瘤患者之间共享。与其它突变相比,来自非编码区翻译的新抗原很少被深入研究和理解。因此,迫切需要开发快速高效的计算算法来筛选这些潜在的新抗原,并验证其用于免疫治疗的可行性。
三、蛋白质组变体
含义:蛋白质组变体来自于翻译失调、PTMs、蛋白酶体加工和与抗原加工相关的转运蛋白(TAP)的异常功能。
来源:
- 异常的 PTMs,包括糖基化、O - 连接的 β-N - 乙酰葡糖胺(O-GlcNAc)和磷酸化,可以在肿瘤中产生 MHC 复合物呈递的新抗原肽。
- 受损的蛋白酶体加工或 TAP 复合物。蛋白酶体处理蛋白质并将其转化为肽,这个步骤对于蛋白质转化为 MHC 限制性表位尤为关键。如果蛋白酶体的活性被抑制,则会降低 MHC-I 肽的产生。
- 肿瘤可以通过产生有缺陷的 HLA-I 抗原处理途径或下调相关基因表达来避免 T 细胞的识别。值得注意的是,在一些 HLA-I 低或者 TAP 缺陷肿瘤中发现了一类称为与肽加工受损相关的 T 细胞表位(TEIPP)的新抗原。是一类来源于肿瘤自身管家蛋白的未突变抗原,可激活 TEIPP 特异性 CD8+T 细胞,并特异性杀死这些 TAP 缺乏的癌症细胞。目前认为,TEIPP 肽具有免疫原性,因为它们不能由正常细胞呈递,并且 TEIPP 特异性 T 细胞可以逃避胸腺的选择。
临床研究:
- 有证据表明,涉及现有单个肽连接的新抗原可以激活 1 型糖尿病(T1D)中的 CD4+T 细胞,表明蛋白质组变异过程可能产生 MHC II 相关的新抗原。
- 200 多项研究报道,蛋白酶体产生的剪接肽能够激活 CD8+T 细胞。
四、病毒来源的肿瘤抗原(病毒 ORFs)
临床研究:
- 九名患有转移性恶性肿瘤的 HPV 阳性患者中,有两名在 ACT 研究中使用了根据病毒抗原的反应性而选择的 TIL,实现了持续的肿瘤消退。
- 在两项独立的临床试验中,用抗 E7 TCR 转导的自体 T 细胞在 12 名患者中有 4 名有反应,而用抗 E6 TCR 转染的 T 细胞在所有 12 名患者都有反应。
值得注意的是,这些临床试验都没有对正常组织产生任何明显的毒性。这些试验证明了靶向致癌病毒蛋白治疗相关肿瘤的安全性和有效性,并且它们在肿瘤发生中是患者共享的,因此病毒衍生的新抗原仍然是癌症免疫治疗的理想靶点。
小结
新抗原是由于基因组、转录组和蛋白质组水平的改变而产生的。目前的研究主要集中在 SNVs 和 INDEL,这是肿瘤细胞基因组水平上最常见的突变类型。然而,SNVs 和 INDEL 产生的新抗原由于患者特异性和免疫原性差而限制了其临床应用,这导致癌症患者的临床受益较少。越来越多的证据表明,癌症新抗原的替代来源,如基因融合、剪接变异体和 PTM,可能是吸引人的免疫治疗新靶点。通过基因融合产生的新抗原,比 SNVs 和 INDEL 新抗原具有更好的免疫原性,后者已被纳入许多临床试验。此外,基因融合产生的新抗原、癌症驱动基因的复发突变、非编码区和异常 PTM 在患者之间共享的可能性更高,为免疫治疗提供了容易公用的新抗原。
参考文献:
Xie, Na, et al. "Neoantigens: promising targets for cancer therapy." Signal Transduction and Targeted Therapy 8.1 (2023): 9