中国首个原创(First-in-class)干细胞新药IND获批,用于治疗肺纤维化
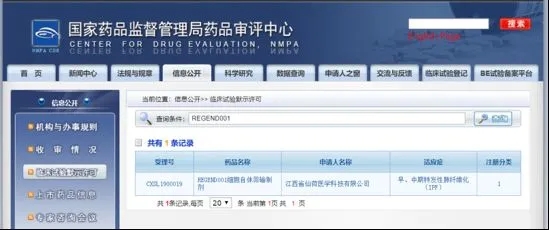
据国家药品监督管理局药品审评中心官网公布消息,江西省仙荷医学科技有限公司(简称仙荷医学)旗下的REGEND001细胞自体回输制剂,于2020年7月15日获得药监局颁发的《药物临床试验批准通知书》(批件号:CXSL1900019),用于治疗早、中期特发性肺纤维化。这款由仙荷医学及其母公司吉美瑞生研发的干细胞新药是全世界第一个获批进入临床的肺干细胞产品,利用独特的肺组织再生修复机制发挥治疗作用,属于真正意义上的First-in-class新药。
特发性肺纤维化(IPF)是一类进展迅速、死亡率高的罕见病,患者诊断后平均生存期仅2.8年,死亡率高于大多数肿瘤。据不完全统计,我国此类病人有50万人以上,近年来其数量呈逐年上升态势。IPF的发病机制与肺泡上皮细胞损伤和成纤维细胞增生有直接关联,导致患者肺脏换气功能出现障碍并最终因呼吸功能衰竭而死亡。目前尚无有效的药物可以改善IPF患者的换气功能障碍。
REGEND001产品的核心成分为支气管基底层来源的成体肺干(祖)细胞,此类细胞具有再生肺组织的功能。通过向患者肺部移植自体肺干细胞,可以有效地再生肺部呼吸单位(肺泡),直接改善肺部血-气交换功能,同时拮抗成纤维细胞的增生,以达到从根本上治疗IPF的目标。
自2018年国家药品审评中心开放细胞治疗产品新药受理以来,截至目前我国已有共计10项干细胞产品通过默示许可获批临床。除REGEND001之外,其它9项均为间充质干细胞产品。与传统的间充质干细胞产品相比,肺干细胞作为肺脏来源的功能细胞类群,在呼吸系统疾病的治疗方面展现出了天然的优势。
REGEND001产品研发专家,国家重点研发计划干细胞专项首席科学家左为教授长期专注于肺脏再生医学研究,相关基础研究论文成果发表在Nature,EMBO和AJRCCM等顶级学术刊物上,并入选了中国医药生物技术2018年度十大进展。2016年至今,左为教授及吉美瑞生团队发起了多项国家干细胞临床研究备案项目,与广州医科大学附属第一医院(钟南山、李时悦团队)、同济大学附属上海市东方医院(郭忠良团队)、上海交大医学院附属瑞金医院(瞿介明团队)等医疗机构合作,基于支气管基底层肺干细胞开展了探索性临床研究。前期部分研究在安全性及有效性方面观察到良好的效果。多年来扎实的基础研究和探索性临床研究对于该原创干细胞新药获批临床起着决定性的作用,同时也为下一阶段的药物研发打下了良好的基础。