NK 细胞:肿瘤治疗的新希望
NK 细胞在杀伤肿瘤方面,尽管大部分仍处于临床 “试验” 阶段,却已经在癌症治疗领域开展得如火如荼。那么,从研究的视角来看,NK 细胞治疗目前处于什么状态呢?又有哪些新的策略和发展呢?今天为大家分享一篇综述 “Innovative Strategies to Improve the Clinical Application of NK Cell-Based Immunotherapy”,该综述介绍了当下 NK 细胞治疗所面临的挑战以及创新策略。文章发表在《Front Immunol.》(影响因子为 8.7)杂志上。
自然杀伤细胞构成了先天免疫系统的一部分,它能够介导对病毒感染和恶性细胞的有效免疫反应。近年来,研究重点聚焦于探索并推进 NK 细胞作为一种主动免疫治疗平台。尽管已经取得了重大进展,但要将 NK 细胞研究有效地转化为临床应用,仍需解决几个关键挑战。这篇综述重点介绍了其中的一些挑战以及为克服这些挑战而开发的创新策略,包括 NK 细胞的体外扩增、体内持久性、肿瘤部位浸润以及预防衰竭等方面。
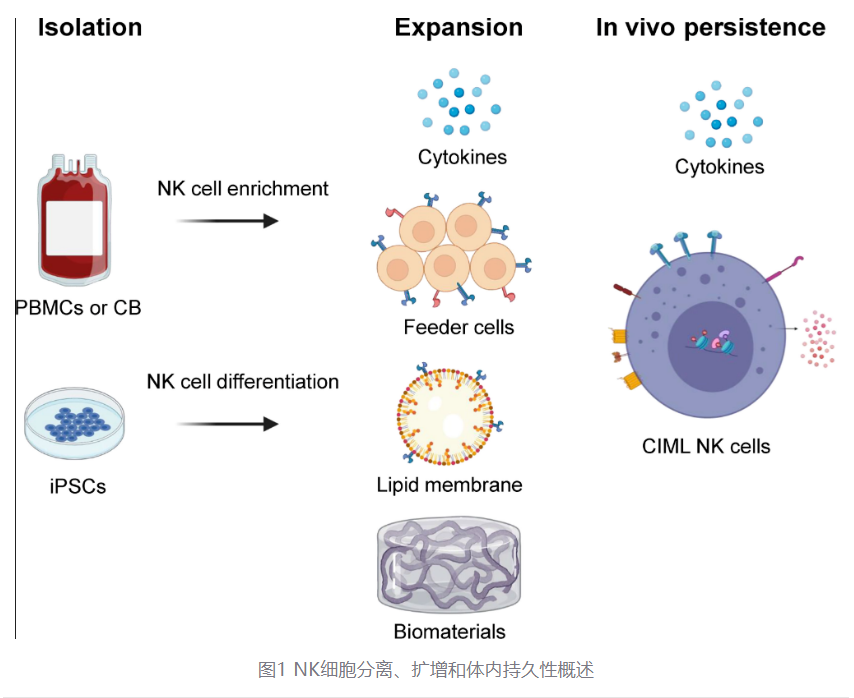
使用 NK 细胞疗法的关键在于获取足够多的细胞。目前有多种 NK 细胞扩增策略和来源可用于生成临床级 NK 细胞产品,包括外周血(PB)、脐带血(CB)、骨髓(BM)以及人诱导多能干细胞(iPSC)(图 1)。NK 细胞可以在输注到患者之前进行离体扩增,或者在细胞因子刺激过继转移后在体内扩增。它们通常通过去除 CD3 + 细胞,然后阳性选择 CD56 + 细胞来分离,或者在某些方案中通过使用磁珠(CliniMACS)单步去除 CD3 + 和 CD19 + 细胞来分离。另一种方法包括从存在于 CB 和 BM 中的富集 CD34 + 祖细胞分化出功能性 NK 细胞。尽管已经为临床应用的 NK 细胞产品制定了良好生产规范指南,但 NK 细胞的来源确实导致了 NK 细胞数量和表型方面的一些重要差异。
传统上,IL - 2 和最近的 IL - 15 已被添加到培养基中,以支持纯化 NK 细胞的活化和扩增。IL - 15 虽然与 IL - 2 具有相似的信号传导功能,但在激活 NK 细胞和 CD8 + T 细胞方面具有选择性,因此更适合用于 NK 细胞的激活和扩增工作。此外,在 K562 饲养细胞上使用膜结合的 IL - 15 和 4 - 1BB 已显示能够导致 NK 细胞显著扩增。
除了靶向给药外,生物材料的独特特性还可用于癌症免疫治疗,尤其是支持免疫细胞的激活和扩增。已经为 T 细胞扩增设计和研究了包括聚合物珠、藻酸盐支架、介孔二氧化硅棒(MSR)、聚异氰肽支架和水凝胶等生物材料。
NK 细胞疗法的功效部分取决于过继转移后注入的细胞在体内持续存在的能力。虽然 NK 细胞可以在体外大量扩增,但在输注后,这些 NK 细胞在体内的持久性和扩增却有限。在过继转移后扩增和激活 NK 细胞的努力通常依赖于细胞因子 IL - 2 或 IL - 15,后者由于其对 NK 细胞的更大选择性而受到一定的青睐。已经产生了一种 IL - 15 突变蛋白的超级激动剂复合物(ALT - 803),在 I 期临床试验中导致 NK 细胞显著扩增和活化。
与血液癌症相比,实体瘤的特征是密集、高度异质、富含基质的肿瘤微环境(TME),其中癌细胞与其微环境之间的串扰有助于推动肿瘤进展、侵袭和转移。TME 由细胞和非细胞成分组成,这些成分通常会阻碍小分子的传递以及输注的过继细胞的浸润,导致只有少数过继转移的淋巴细胞会转移到肿瘤部位。已经研究了各种策略来潜在地克服这一主要障碍,包括利用趋化因子网络有效地将 NK 细胞浸润到 TME 中,赋予 NK 细胞特定的特征以克服免疫抑制性 TME,以及改变 TME 为过继转移的免疫细胞创造有利的生态位。
可溶性趋化因子与其受体之间的相互作用在淋巴细胞的迁移中起着重要作用。受体对 NK 细胞的作用包括 CCR2、CCR5 和 CXCR3。CCR2 已被证明可促进 NK 细胞募集到黑色素瘤浸润的淋巴结中。对 NK 细胞进行了基因工程修饰,改变了趋化因子受体的表达,以调节其归巢到实体瘤或转移部位。除细胞因子外,据报道用 TGFβ1 处理 NK 细胞可调节包括 CXCR3/CXCR4 在内的趋化因子受体的表达,这进一步增加了它们在肿瘤中的浸润。另一种增强 NK 细胞浸润到肿瘤部位的方法涉及操纵免疫抑制性 TME,为注入的 NK 细胞创造有利的生态位。许多研究表明,瘤内注射 IFNγ 可诱导 TME 中 CXCL9、CXCL10 和 CXCL11 的表达,进而增加 NK 细胞的局部浸润。
可以使用嵌合抗原受体(CAR)来增强 NK 细胞靶向肿瘤的能力。随着最近 NK 细胞逆转录病毒转导效率和 CAR 工程的改进,这种方法已成为现实。在晚期淋巴瘤患者中使用 CAR 转导的 NK 细胞证明了这种方法的前景。最近有人努力使用基因编辑的 iPSCs 分化为带有 CAR 的 NK 细胞。iPSC 衍生的 NK 细胞可以更稳定地表达 CAR,并且可以作为生成 CAR - NK 比 CB 更好的现成选择。在 CAR 的背景下,它们更不成熟的表型和通常较低的 KIR 表达是否会成为疗效的障碍仍有待确定。
早期 NK 细胞临床试验显示了良好的安全性以及利用 NK 细胞工程进展所带来的有希望的反应,包括分化为记忆样表型或配备 CAR。然而,这些研究有一个共同的特点,即最初的肿瘤负荷减少,随后大多数接受治疗的患者最终再次出现可检测到的疾病。这些观察结果可部分归因于肿瘤逃逸机制和过继性 NK 细胞的耗竭。
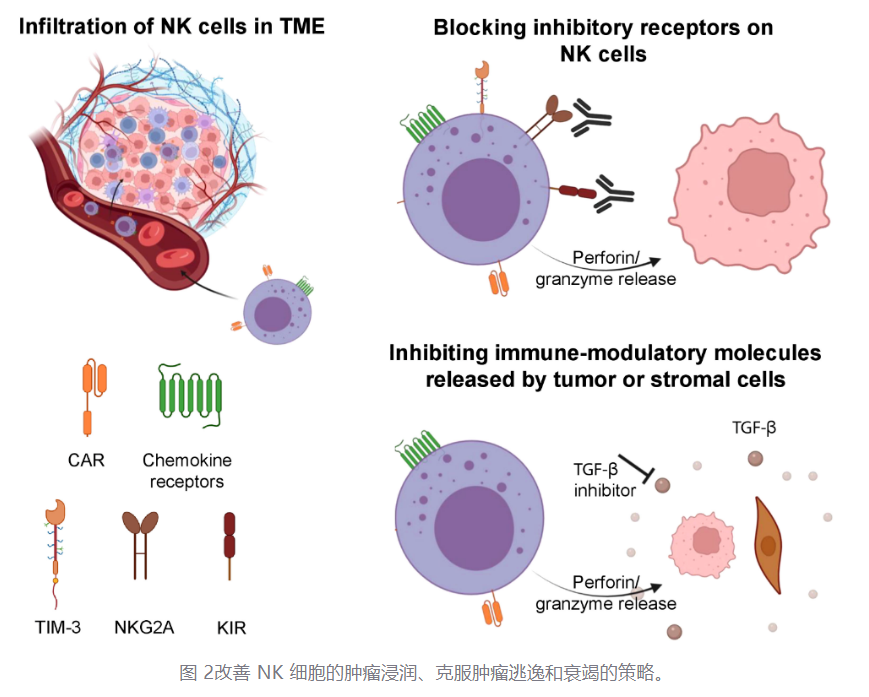
正常细胞向恶性细胞的转化需要精细的适应和致癌变化,使肿瘤能够绕过免疫效应细胞的检测和消除。其中一些适应包括下调或脱落激活 NK 细胞的配体(例如 MICA/B),从肿瘤细胞或支持基质细胞(例如 TGFβ)中释放免疫调节分子,以及表观遗传变化(例如组蛋白去乙酰化酶、HDAC)。NK 细胞介导的疗法必须克服肿瘤从 NK 细胞中逃逸的问题,才能成为独立的治疗方法,而无需随后与其他疗法进行整合。当前克服肿瘤逃逸的策略包括但不限于逆转 NK 细胞无能,将 NK 细胞疗法与可发挥其抗体依赖细胞介导的细胞毒性(ADCC)功能的抗体介导疗法相结合,以及开发可用以靶向逃逸肿瘤细胞的 CAR 进行转导(图 2)。
TME 中的大量免疫抑制途径结合起来抑制 NK 细胞功能。TME 中耗尽或受损的 NK 细胞表现出效应细胞因子下调、颗粒减少、NKG2D 下调、转录因子如 Emesodermin 和 T - bet 的减少以及抑制性受体如 PD - 1、TIM - 3、TIGIT 和 NKG2A 的上调。后一种标志物在 NK 细胞上的表达与 NK 细胞功能下降相关,重要的是,各种研究表明,阻断这些受体可以增加 NK 细胞的细胞毒性和功能。
这篇综述通俗易懂,将 NK 细胞的应用现状进行了简单扼要的归纳整理。虽然没有远瞻的思路和创新性思维,但是对于研究 NK 细胞杀伤的初学者来说,能够方便快速地找到方向,是一篇不错的小综述。
自然杀伤细胞构成了先天免疫系统的一部分,它能够介导对病毒感染和恶性细胞的有效免疫反应。近年来,研究重点聚焦于探索并推进 NK 细胞作为一种主动免疫治疗平台。尽管已经取得了重大进展,但要将 NK 细胞研究有效地转化为临床应用,仍需解决几个关键挑战。这篇综述重点介绍了其中的一些挑战以及为克服这些挑战而开发的创新策略,包括 NK 细胞的体外扩增、体内持久性、肿瘤部位浸润以及预防衰竭等方面。
一、产生和扩增 NK 细胞的方法
使用 NK 细胞疗法的关键在于获取足够多的细胞。目前有多种 NK 细胞扩增策略和来源可用于生成临床级 NK 细胞产品,包括外周血(PB)、脐带血(CB)、骨髓(BM)以及人诱导多能干细胞(iPSC)(图 1)。NK 细胞可以在输注到患者之前进行离体扩增,或者在细胞因子刺激过继转移后在体内扩增。它们通常通过去除 CD3 + 细胞,然后阳性选择 CD56 + 细胞来分离,或者在某些方案中通过使用磁珠(CliniMACS)单步去除 CD3 + 和 CD19 + 细胞来分离。另一种方法包括从存在于 CB 和 BM 中的富集 CD34 + 祖细胞分化出功能性 NK 细胞。尽管已经为临床应用的 NK 细胞产品制定了良好生产规范指南,但 NK 细胞的来源确实导致了 NK 细胞数量和表型方面的一些重要差异。
二、用于激活和扩增 NK 细胞的生物材料
传统上,IL - 2 和最近的 IL - 15 已被添加到培养基中,以支持纯化 NK 细胞的活化和扩增。IL - 15 虽然与 IL - 2 具有相似的信号传导功能,但在激活 NK 细胞和 CD8 + T 细胞方面具有选择性,因此更适合用于 NK 细胞的激活和扩增工作。此外,在 K562 饲养细胞上使用膜结合的 IL - 15 和 4 - 1BB 已显示能够导致 NK 细胞显著扩增。
除了靶向给药外,生物材料的独特特性还可用于癌症免疫治疗,尤其是支持免疫细胞的激活和扩增。已经为 T 细胞扩增设计和研究了包括聚合物珠、藻酸盐支架、介孔二氧化硅棒(MSR)、聚异氰肽支架和水凝胶等生物材料。
三、输注后 NK 细胞的体内持久性
NK 细胞疗法的功效部分取决于过继转移后注入的细胞在体内持续存在的能力。虽然 NK 细胞可以在体外大量扩增,但在输注后,这些 NK 细胞在体内的持久性和扩增却有限。在过继转移后扩增和激活 NK 细胞的努力通常依赖于细胞因子 IL - 2 或 IL - 15,后者由于其对 NK 细胞的更大选择性而受到一定的青睐。已经产生了一种 IL - 15 突变蛋白的超级激动剂复合物(ALT - 803),在 I 期临床试验中导致 NK 细胞显著扩增和活化。
四、增强 NK 细胞浸润和靶向实体瘤的策略
与血液癌症相比,实体瘤的特征是密集、高度异质、富含基质的肿瘤微环境(TME),其中癌细胞与其微环境之间的串扰有助于推动肿瘤进展、侵袭和转移。TME 由细胞和非细胞成分组成,这些成分通常会阻碍小分子的传递以及输注的过继细胞的浸润,导致只有少数过继转移的淋巴细胞会转移到肿瘤部位。已经研究了各种策略来潜在地克服这一主要障碍,包括利用趋化因子网络有效地将 NK 细胞浸润到 TME 中,赋予 NK 细胞特定的特征以克服免疫抑制性 TME,以及改变 TME 为过继转移的免疫细胞创造有利的生态位。
五、参与将 NK 细胞运输到肿瘤部位的关键趋化因子网络
可溶性趋化因子与其受体之间的相互作用在淋巴细胞的迁移中起着重要作用。受体对 NK 细胞的作用包括 CCR2、CCR5 和 CXCR3。CCR2 已被证明可促进 NK 细胞募集到黑色素瘤浸润的淋巴结中。对 NK 细胞进行了基因工程修饰,改变了趋化因子受体的表达,以调节其归巢到实体瘤或转移部位。除细胞因子外,据报道用 TGFβ1 处理 NK 细胞可调节包括 CXCR3/CXCR4 在内的趋化因子受体的表达,这进一步增加了它们在肿瘤中的浸润。另一种增强 NK 细胞浸润到肿瘤部位的方法涉及操纵免疫抑制性 TME,为注入的 NK 细胞创造有利的生态位。许多研究表明,瘤内注射 IFNγ 可诱导 TME 中 CXCL9、CXCL10 和 CXCL11 的表达,进而增加 NK 细胞的局部浸润。
六、用嵌合抗原受体武装 NK 细胞以增强肿瘤免疫治疗
可以使用嵌合抗原受体(CAR)来增强 NK 细胞靶向肿瘤的能力。随着最近 NK 细胞逆转录病毒转导效率和 CAR 工程的改进,这种方法已成为现实。在晚期淋巴瘤患者中使用 CAR 转导的 NK 细胞证明了这种方法的前景。最近有人努力使用基因编辑的 iPSCs 分化为带有 CAR 的 NK 细胞。iPSC 衍生的 NK 细胞可以更稳定地表达 CAR,并且可以作为生成 CAR - NK 比 CB 更好的现成选择。在 CAR 的背景下,它们更不成熟的表型和通常较低的 KIR 表达是否会成为疗效的障碍仍有待确定。
七、克服肿瘤逃逸和衰竭的机制
早期 NK 细胞临床试验显示了良好的安全性以及利用 NK 细胞工程进展所带来的有希望的反应,包括分化为记忆样表型或配备 CAR。然而,这些研究有一个共同的特点,即最初的肿瘤负荷减少,随后大多数接受治疗的患者最终再次出现可检测到的疾病。这些观察结果可部分归因于肿瘤逃逸机制和过继性 NK 细胞的耗竭。
正常细胞向恶性细胞的转化需要精细的适应和致癌变化,使肿瘤能够绕过免疫效应细胞的检测和消除。其中一些适应包括下调或脱落激活 NK 细胞的配体(例如 MICA/B),从肿瘤细胞或支持基质细胞(例如 TGFβ)中释放免疫调节分子,以及表观遗传变化(例如组蛋白去乙酰化酶、HDAC)。NK 细胞介导的疗法必须克服肿瘤从 NK 细胞中逃逸的问题,才能成为独立的治疗方法,而无需随后与其他疗法进行整合。当前克服肿瘤逃逸的策略包括但不限于逆转 NK 细胞无能,将 NK 细胞疗法与可发挥其抗体依赖细胞介导的细胞毒性(ADCC)功能的抗体介导疗法相结合,以及开发可用以靶向逃逸肿瘤细胞的 CAR 进行转导(图 2)。
TME 中的大量免疫抑制途径结合起来抑制 NK 细胞功能。TME 中耗尽或受损的 NK 细胞表现出效应细胞因子下调、颗粒减少、NKG2D 下调、转录因子如 Emesodermin 和 T - bet 的减少以及抑制性受体如 PD - 1、TIM - 3、TIGIT 和 NKG2A 的上调。后一种标志物在 NK 细胞上的表达与 NK 细胞功能下降相关,重要的是,各种研究表明,阻断这些受体可以增加 NK 细胞的细胞毒性和功能。
小结
这篇综述通俗易懂,将 NK 细胞的应用现状进行了简单扼要的归纳整理。虽然没有远瞻的思路和创新性思维,但是对于研究 NK 细胞杀伤的初学者来说,能够方便快速地找到方向,是一篇不错的小综述。